
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足图示转化关系的是

甲 | 乙 | 丙 | 戊 | |
① | NH3 | O2 | NO | H2O |
② | Fe | H2O | H2 | Fe2O3 |
③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
④ | Na2O2 | CO2 | O2 | Na |
A.①③ B.②③ C.②④ D.①④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届湖北省襄阳市高三上学期期中测试化学试卷(解析版) 题型:选择题
根据反应(1)→(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是
(1)Cl2+2KI=2KCl+I2;
(2)2FeCl2+Cl2=2FeCl3;
(3)2FeCl3+2HI=2FeCl2+2HCl+I2;
(4)H2S+I2=S+2HI;
A.S>I2>Fe3+>Cl2 B.Cl2>Fe3+>I2>S
C.Fe3+>Cl2>S>I2 D.Cl2>I2>Fe3+>S
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高三上学期10月阶段性教学质检化学试卷(解析版) 题型:填空题
废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
(1)回收二氯化锰。将废旧锌锰电池处理,得到含MnO(OH)混合物,向该混合物加入浓盐酸并加热,试写出MnO(OH)与浓盐酸反应的化学方程式: 。
(2)制备锰锌铁氧体。锰锌铁氧体可用作隐形飞机吸收雷达波的涂料。一种以锌锰废电池为原料制备锰锌铁氧体的主要流程如下:
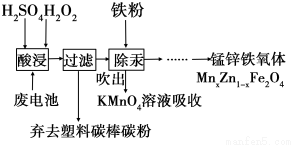
除汞时,铁粉的作用是______________ _(填“氧化剂”或“还原剂”或“吸附剂”);MnxZn1-xFe2O4中Fe元素为+3价,则Mn元素的化合价为 。
(3)在不同pH下,KMnO4溶液对Hg的吸收率的影响及主要产物如下图。

据图说明pH对Hg吸收率的影响规律 ;在强酸性环境下Hg的吸收率高的原因可能是 。
(4)锰回收新方法。向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为:2MnO(OH)+ MnO2+2H2C2O4 +3H2SO4 = 3MnSO4+ 4CO2↑+6H2O
①每1molMnO2参加反应时,共有 mol电子发生转移。
②新方法的优点是 (答1点即可)。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省西安市高三上学期10月月考化学试卷(解析版) 题型:选择题
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g) 3Z(g),平衡时, X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时, X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016届浙江省杭州市高三上学期10月月考化学试卷(解析版) 题型:填空题
(Ⅰ).A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为 。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式: ;
(4)工业上在高温的条件下,可以用A2C与BC反应制取单质A2。在等体积的I、II两个密闭容器中分别充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是 。
A.达到平衡所需要的时间:I>II
B.达到平衡后A2C的转化率:I=II
C.达到平衡后BC的物质的量:I>II
D.达到平衡后A2的体积分数:I<II
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为 。
(Ⅱ).A、B、C、D、E、F是短周期元素组成的中学常见的物质,他们的转化关系如图所示(部分反应条件略去):
(1)若所有转化都是非氧化还原反应,B、D、E含有同种金属元素,F为强碱(部分产物略去),则B+D→E的离子方程式为 ,C为同周期元素构成的1:1型化合物,则C的电子式为 。
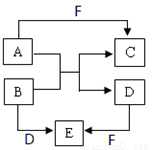
(2)若A、D、F为单质,B、C、E为化合物,B为两种非金属元素所组成的化合物,则E的化学式为 。A+B→C+D的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016届广东省英德市高三上学期第二次月考理综化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式.其中正确的是
A.向NaAlO2溶液中通入过量的CO2:2AlO2﹣+CO2+3H2O═2Al(OH)3↓+CO32﹣
B.NH4HCO3溶液中加入过量氢氧化钠溶液:NH4++OH﹣═ NH3·H2O
C.AlCl3溶液中滴加过量氨水:Al3+ + 3NH3·H2O ═ 3NH4++ Al(OH)3↓
D.磁性氧化铁(Fe3O4)溶于稀硝酸3Fe2++4H++NO3﹣═3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上学期10月月考化学试卷(解析版) 题型:简答题
(6分)铜及其化合物在工业、农业、科技和日常生活中有广泛应用。
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。
为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应,请完成下列离子方程式:
Cu2S+ MnO4-+
MnO4-+ H+
H+
 Cu2++
Cu2++ SO42-+
SO42-+ Mn2++
Mn2++ H2O
H2O
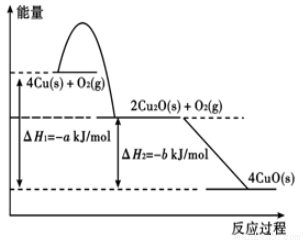
(2)现有一块含有铜绿[Cu2(OH)2CO3]
的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。①固态铜与适量氧气反应,能量变化如图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式
②上述铜片中铜的生锈率为
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期第一次诊断测试化学试卷(解析版) 题型:简答题
氧化还原反应是化学反应中的基本反应之一,研究氧化还原反应,对人类的进步具有极其重要的意义。
(1)已知:2BrO3-+C12=Br2+2C1O3- ; 5C12+I2+6H2O=2HIO3+10HC1;
C1O3-+5C1-+6H+=3C12+3H2O
则C1O3-、BrO3-、IO3-、C12的氧化性由弱到强的排序为
(2)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验加以证明。(提示:请写出实验步骤、现象及结论)①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液
(3)二十世纪初期,化学家合成出极易溶于水的NaBH4。在强碱性条件下,常用NaBH4处理含Au3+的废液生成单质Au,已知,反应后硼元素以BO2-形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为
(4)某强氧化剂[RO(OH)2]+ 能将Na2SO3氧化。已知含2.0×10-3 mol [RO(OH)2]+ 离子的溶液,恰好跟25.0 mL 0.2 mol/L 的Na2SO3溶液完全反应,则反应后R的化合价为 价。
(5)将32 g 铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①待产生的气体全部释放后,向溶液加入V mL amol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。(用含V、a的式子表示)
①欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要H202的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省泰州市姜堰区高二上学期期中必修化学试卷(解析版) 题型:选择题
化学与生活密切相关。下列生活中常见物质的俗名与化学式相对应的是
A.苏打——NaHCO3
B.胆矾——ZnSO4
C.酒精——C2H5OH
D.生石灰——Ca(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com