
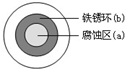
| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-→4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-→Cu2+ |
分析 NaCl溶液滴到一块光亮清洁的铁板表面上,一段时间后在液滴覆盖的圆周中心区(a)被腐蚀变暗,实际上是发生了吸氧腐蚀,这时,负极电极反应为:Fe-2e-=Fe2+ (发生氧化反应)正极电极反应为:O2+2H2O+4e-=4OH- (发生还原反应)在液滴外沿,由于Fe2++2OH-=Fe(OH)2,4Fe(OH)2+O2+2H2O=4Fe(OH)3 形成了棕色铁锈环(b).
解答 解:A.根据在原电池中,阳离子移向正极,阴离子移向负极的规律,Cl-应由b区向a区迁移,故A错误;
B.O2在液滴外沿反应,正极电极反应为:O2+2H2O+4e-=4OH- (发生还原反应),故B正确;
C.液滴下的Fe因发生氧化反应而被腐蚀,故C错误;
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,由于Fe的金属活动性比铜强,Fe仍为负极,负极发生的电极反应为:Fe-2e-=Fe2+,故D错误.
故选B.
点评 本题考查氧化还原反应、电化学等方面知识,注意在原电池中,阳离子移向正极,阴离子移向负极.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
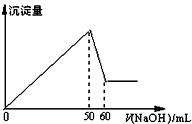 在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgCl2的物质的量浓度
在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgCl2的物质的量浓度| A. | 1:1 | B. | 3:1 | C. | 1:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl水溶液 | B. | NaCl与酒精形成的胶体 | ||
| C. | 黄色的FeCl3溶液 | D. | 无色透明的CCl4液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 非金属性强弱 | |
| A | CH4受热分解的温度比SiH4高 | C>Si |
| B | C与SiO2在高温下反应生成Si和CO | C>Si |
| C | 稀盐酸与Na2SiO3溶液反应生成H2SiO3胶体 | Cl>Si |
| D | H2SO3是中强酸,H2SiO3是弱酸 | S>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-+H2O?HCO3-+OH- 热的纯碱溶液清洗油污 | |
| B. | Al3++3H2O?Al(OH)3 (胶体)+3 H+ 明矾净水 | |
| C. | TiCl4+(x+2)H2O(过量)?TiO2•x H2O+4HCl 用TiCl4制备TiO2 | |
| D. | SnCl2+H2O?Sn(OH)Cl+HCl 配制氯化亚锡溶液时应加入氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸互为同分异构体 | |
| B. | 乙醇、乙酸都能与钠反应 | |
| C. | 乙醇、乙酸都能与NaOH溶液反应 | |
| D. | 乙醇、乙酸都能使紫色石蕊试液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
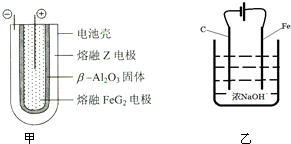 铝、铁是两种重要的金属元素,其单质及化合物在生产生活中的应用日趋广泛.
铝、铁是两种重要的金属元素,其单质及化合物在生产生活中的应用日趋广泛.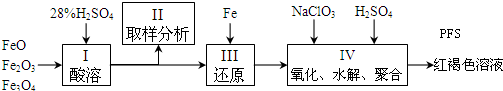
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是一种钠盐 | B. | 是一种酸式盐 | C. | 水溶液显酸性 | D. | 是一种电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com