
(12分)
(1)实验室用氯化铵固体制取氨气的化学方程式是 。
(2)将4.48L(标准状况)氨气通入水中得到0.05L溶液,所得溶液的物质的量浓度是 。
(3)现有100mL AlCl3与MgSO4的混合溶液,分成两等份。
①向其中一份中加入10mL 4mol/L的氨水,恰好完全反应,其中AlCl3与氨水反应的离子方程式是 。继续加入l mol/L NaOH溶液至10mL时,沉淀不再减少,沉淀减少的离子方程式是 ,减少的沉淀的物质的量是 。
②向另一份中加入a mL 1mol/LBaCl2溶液能使SO42-沉淀完全,a= 。
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:阅读理解
 NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.| 浓硝酸 |
| 稀硝酸 |
| 氯气 |
| 硝酸 |
| 空气 |
| 硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
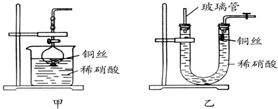
 某同学实验室用下列装置探究氯气的性质.
某同学实验室用下列装置探究氯气的性质.查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省临沂市高三3月教学质量检测(一模)化学试卷(解析版) 题型:填空题
氯化铁是一种重要的化工原料,无水氯化铁遇潮湿空气极易吸水生成FeCl3·nH2O。
(1)实验室用如下装置(部分加热、夹持等装置已略去)制备无水氯化铁固体。
?? 
①装置A中仪器z的名称是___________。
②简述检验装置A气密性的操作:______________________。
③按气流方向连接各仪器接口,顺序为a→_________ →__________ →_________ →__________→b→c→_________→__________,装置D的作用是______________________。
(2)工业上制备无水氯化铁的一种工艺流程如下:

①吸收塔中发生反应的离子方程式为_________________________________________。
②简述由FeCl3·6H2O晶体得到无水氯化铁的操作:________________________________。
③用碘量法测定所得无水氯化铁的质量分数:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶中,用蒸馏水定容;取出10 mL,加入稍过量的KI溶液,充分反应后,滴入指示剂_________(填试剂名称),用c mol/L的Na2S2O3溶液进行滴定,终点时消耗V mLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)。则样品中氯化铁的质量分数为____________。
(3)若已知:
Fe(OH)3(aq) Fe3+(aq)+3OH-(aq)? △H=a kJ/mol
Fe3+(aq)+3OH-(aq)? △H=a kJ/mol
H2O(l) H+(aq)+OH-(aq)?? △H=b kJ/mol
H+(aq)+OH-(aq)?? △H=b kJ/mol
请写出Fe3+发生水解反应的热化学方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源:0118 期末题 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:
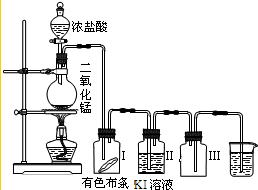
(1)实验室用二氧化锰跟浓硫酸共热反应,二氧化锰被还原成Mn2+并制取氯气的化学方程式是___________________________________。
(2)高锰酸钾是常用的氧化剂。在酸性条件下,MnO4-被还原成Mn2+。用高锰酸钾跟浓盐酸在室温下制氯气的反应的离子方程式是___________________________。
(3)历史上曾用“地康法”制氯气。该方法是用氯化铜作催化剂,在450℃利用空气中的氧气跟氯气反应制氯气,反应的化学方程式为________________________________。
(4)从氯元素化合价的变化看,以上三种方法的共同点是______________________。
(5)比较以上三个反应,可认为氧化剂的氧化能力从强到弱的顺序为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com