
| A. | 49克硫酸 | B. | 0.8摩尔氧气 | ||
| C. | 6克氢气 | D. | 6.02×1023 个二氧化硫分子 |
分析 根据N=nNA可知,原子的物质的量越大,所含有原子数最多,先计算出各选项中含有原子的物质的量,根据计算结果进行判断.
解答 解:A.49g硫酸的物质的量为:$\frac{49g}{98g/mol}$=0.5mol,0.5mol H2SO4中含有原子的物质的量为:0.5mol×7=3.5mol;
B.0.8mol氧气分子中含有氧原子的物质的量为:0.8mol×2=1.6mol;
C.6g氢气的物质的量为:$\frac{6g}{2g/mol}$=3mol,含有H原子的物质的量为:3mol×2=6mol;
D.6.02×1023个二氧化硫分子的物质的量为:$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1mol,1mol二氧化硫分子中含有原子的物质的量为:1mol×3=3mol;
根据N=nNA可知,原子的物质的量越大,所含原子数最多,所以含有原子数最多的为6克氢气,
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数等物理量之间的关系为解答关键,试题侧重基础知识的考查,有利于提高学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
| 实验探究 | 实验操作及现象 | 结论分析 |
| 探究一 | 将淡蓝绿色粉末溶解于盐酸溶液中,取上清液2份, ①1份滴加BaCl2溶液,产生白色沉淀,再加盐酸,无明显变化. ②另1份溶液先滴加KSCN溶液,无明显变化,再滴加双氧水,后滴加KSCN溶液溶液,变成血红色. | 证明淡蓝绿色粉末为FeSO4 |
| 探究二 | 将红色物质研成粉末,滴加盐酸,无明显变化,再滴加KSCN溶液,无明显现象. | 证明:红色物质不是Fe2O3. |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;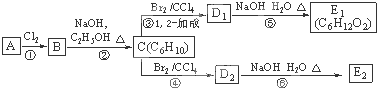
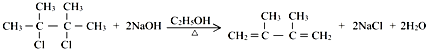 ;
; +Br2→
+Br2→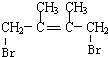 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com