
室温时,0.1 mol·L-1的HA 溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,有关叙述正确的是
| A.原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B.当滴入少量的NaOH,促进了HA的电离,溶液的pH降低 |
| C.当恰好完全中和时,溶液呈中性 |
| D.当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |
A
解析试题分析:0.1 mol·L-1的HA 溶液的pH=3,可知HA是弱酸,在水溶液中发生电离的方程式为:HA A-+H+。B项:加入NaOH,OH-与H+反应,促进了HA的电离,溶液的pH升高,故B错。C项:当恰好完全中和时,溶质为NaA,NaA是强碱弱酸盐,水解溶液呈碱性,故C错。D项:c(A-)>c(Na+)>c(OH-)>c(H+),这个关系式,c(A-)+c(OH-)>c(Na+)+c(H+)违反了电荷守恒,即不符合电荷总数为O,不可能出现这种情况,故D错。故选A。
A-+H+。B项:加入NaOH,OH-与H+反应,促进了HA的电离,溶液的pH升高,故B错。C项:当恰好完全中和时,溶质为NaA,NaA是强碱弱酸盐,水解溶液呈碱性,故C错。D项:c(A-)>c(Na+)>c(OH-)>c(H+),这个关系式,c(A-)+c(OH-)>c(Na+)+c(H+)违反了电荷守恒,即不符合电荷总数为O,不可能出现这种情况,故D错。故选A。
考点:弱酸的电离 盐类的水解
点评:注意弱酸的在水溶液中不完全电离;盐类的水解中“谁若谁水解,谁强显谁性”,水溶液中的离子电荷守恒。


科目:高中化学 来源: 题型:
A、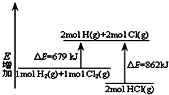 表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183 kJ?mol-1 | B、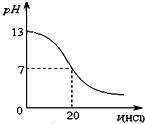 表示室温时用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1NaOH溶液,溶液pH随加入酸体积变化 | C、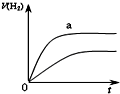 表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | D、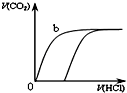 表示10 mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1mol/L HCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E五种离子化合物形成的溶液,分别由K+、NH4+、Ag+、Ba2+、Fe3+、Cl-、OH-、CO32-、SO42-、NO3-中的阳离子和阴离子各一种组成(五种离子化合物所含阴、阳离子各不相同)。已知:①室温时,0.1 mol·L-1B溶液的pH=10,②C、D、E三种溶液的pH均小于7,③C溶液分别与其他四种溶液反应均生成沉淀,④A溶液与D溶液在加热条件下反应既产生白色沉淀又产生刺激性气味的气体,生成的白色沉淀不溶于稀硝酸。
(1)试根据以上实验事实可以推断(用化学式表示)
B为_________;C为_________;D为________。
(2)写出下列反应的离子方程式:
A溶液与D溶液混合(加热) ;
C溶液与E溶液混合 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江嵊泗中学高二下学期第二次月考化学试卷(平行班)(带解析) 题型:填空题
(10分)已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液的pH=________;
(2)HA的电离平衡常数K=________;
(3)升高温度时,K将______(填“增大”、“减小”或“不变”),pH将______(填“增大”、“减小”或“不变”);
(4)由HA电离出的c(H+)约为水电离出的c(H+)的________倍。
查看答案和解析>>
科目:高中化学 来源:2011届浙江金华一中高三上学期期中考试化学试卷 题型:填空题
现有A、B、C、D、E五种离子化合物形成的溶液,分别由K+、NH4+、Ag+、Ba2+、Fe3+、Cl-、OH-、CO32-、SO42-、NO3-中的阳离子和阴离子各一种组成(五种离子化合物所含阴、阳离子各不相同)。已知:①室温时,0.1 mol·L-1B溶液的pH=10,②C、D、E三种溶液的pH均小于7,③C溶液分别与其他四种溶液反应均生成沉淀,④A溶液与D溶液在加热条件下反应既产生白色沉淀又产生刺激性气味的气体,生成的白色沉淀不溶于稀硝酸。
(1)试根据以上实验事实可以推断(用化学式表示)
B为_________;C为_________;D为________。
(2)写出下列反应的离子方程式:
A溶液与D溶液混合(加热) ;
C溶液与E溶液混合 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com