
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① | ||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | ||
三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
四 | ⑾ | ⑿ | ⒀ | ||||
(1) 表中元素______的非金属性最强;元素______的金属性最强;元素______的单质室温下呈液态(填写元素符号);
(2) 表中元素⑿的原子结构示意图是___________;
(3) 表中元素⑤在周期表中的位置为____________________;
(4) 表中元素⑨和⑩最高价氧化对应水化物的酸性:__________>__________。
【答案】F K Br 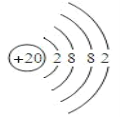 第二周期ⅥA族 HClO4 H2SO4
第二周期ⅥA族 HClO4 H2SO4
【解析】
(1)在元素周期表中,越往右上的元素,非金属性越强(稀有气体除外),即⑥F元素的非金属性最强。金属性与非金属性则相反,在所给的元素中,⑾K元素的金属性最强。将表中所有元素的单质整理分析判断,易知⒀的单质为溴单质,常温下为红棕色液体,因而该空填Br。
(2)元素⑿为Ca元素,原子序数为20,因而原子结构示意图为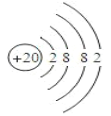 。
。
(3)观察元素⑤在表中的位置可知,其位于第二周期ⅥA族。
(4)元素⑨和⑩最高价氧化物对应水化物分别是H2SO4和HClO4,同一周期从左到右的元素,其最高价氧化物对应水化物的酸性依次增强,因而HClO4> H2SO4。


科目:高中化学 来源: 题型:
【题目】华中科技大学一项科学研究表明:一种被称为Li-空气微型石墨烯超级电容器的电池,它充电和放电的速率是标准电池的100至1000倍。该电池由单原子层的碳构成,放电时将锂氧化产生锂离子和电子,空气中的氧分子得到电子进行还原反应,从而产生电能。则下列说法正确的是
A. Li电极是该电池的正极
B. O2在电极上发生氧化反应,其电极反应式为:O2 + 2H2O + 4e-=4OH-
C. 12g单层石墨中含有六元环的个数为0.5NA(结构示意图如图,NA表示阿伏加德罗常数的值)

D. 放电时,电池中有OH-向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为反应2H2(g)+O2(g)===2H2O(g)的能量变化示意图,下列说法错误的是

A.拆开2molH2(g)和1molO2(g)中的化学键共吸收1368kJ能量
B.由H、O原子形成2molH2O(g),共放出1852kJ能量
C.1molH2(g)和1/2molO2(g)反应生成1molH2O(l),放出热量小于242kJ
D.2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+、B+、C-、D、E、F2- 6种微粒(分子或离子),它们分别含10个电子,其中只有B+和F2-为单核微粒,且C-和E的组成元素相同,已知它们有如下转化关系:A++C-![]() D+E,据此回答下列问题:
D+E,据此回答下列问题:
(1)写出D的结构式___________,E的结构式___________。
(2)实验室制备D物质的反应方程式________。
(3)上述六种微粒中所含有的元素原子半径从大到小的顺序是__(用元素符号表示)。
(4)B、F两元素组成的原子数目比为1:1的化合物的电子式___________、该物质中存在的化学键有__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合催化剂.
已知:氯化铜容易潮解.

实验室用如图所示装置,用还原铜粉和氯气来制备氯化铜.

(1)石棉绒的作用是_________; E装置中的试剂是_____其作用____________ 。
(2)先点燃A处酒精灯,再点燃D处酒精灯的目的是______________________。
(3)若实验测得CuCl2质量分数为90.0%,则其中可能含有的杂质是_____(一种即可)。
(4)溶解时加入HCl溶液的目的主要是__________________________(结合离子方程式回答).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.  的结构中含有酯基
的结构中含有酯基
B. 顺-2-丁烯和反-2-丁烯的加氢产物不同
C. 1mol葡萄糖可水解生成2 mol乳酸(C3H6O3)
D. 芥子醇  能发生氧化,取代,水解,加聚反应
能发生氧化,取代,水解,加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表中“族”的说法正确的是( )
A. 元素周期表中共有七个主族、八个副族、一个0族
B. 同一主族元素原子最外层的电子数目不一定相同
C. 同一主族元素的化学性质相同
D. 族序数后标注A的元素是主族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:_______与盐酸反应最剧烈,____与盐酸反应最慢。
Ⅱ. 利用如图装置可以验证非金属性的变化规律。
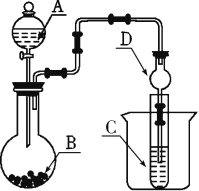
(2)仪器A的名称为_______,干燥管D的作用是_____。
(3)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为___、___、.____,装置C中的实验现象为有黄色沉淀生成,离子方程式为__________________。
(4)若要证明非金属性:S>C>Si,则A中加____,B中加Na2CO3,C中加_____,观察到C中溶液的现象为_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以反应 5H2C2O4+2MnO4 -+6H+ = 10CO2↑+ 2Mn2+ + 8H2O 为例探究“外界条件对化学反应速率的影响”。实验时,分别量取 H2C2O4 溶液和酸性 KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
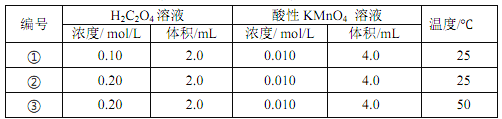
下列说法不正确的是
A. 实验①、 ②、 ③所加的H2C2O4 溶液均要过量
B. 若实验①测得 KMnO4溶液的褪色时间为 40 s, 则这段时间内平均反应速率 v(KMnO4)= 2. 5×10-4 mol/L/s
C. 实验①和实验②是探究浓度对化学反应速率的影响, 实验②和③是探究温度对化学反应速率的影响
D. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的 Mn2+对反应起催化作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com