
(NH4)2Fe(SO4)2·6H2O俗名摩尔盐,价格便宜,可用来净水或治疗缺铁性贫血等,是一种重要的化工原料。
(1)摩尔盐的水溶液呈?????? 色。
(2)c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是????? 。
(3)甲乙两位同学想测定一瓶摩尔盐的纯度。甲同学设计的实验装置如图1:
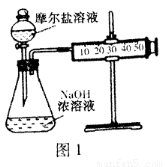
从上图推断甲同学想通过测定??????? 计算摩尔盐的纯度。该方案的不足之处在于??????????????? 。
(4)乙同学在甲同学的基础上做了改进,其实验装置如图2:
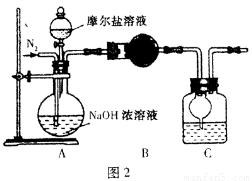
则B与C中的试剂分别是???????????? 和??????????????? 。C中干燥管的作用是???????????????????????? 。乙同学称取了10.0g的摩尔盐样品,若实验完毕后测得洗气瓶及瓶内溶液共增重O.68 g,则依此数据推算这份摩尔盐的纯度为?????? %(答案精确到小数点后第一位)。
(1)浅绿 (2分)
(2)硫酸亚铁(2分)
(3)生成氨气的体积 (2分)
氨气有一部分会溶解在溶液中(或其它合理解释)(2分)
(4)碱石灰 (2分)?? 稀硫酸(2分)?? 防止倒吸(2分)?? 78.4(2分)
【解析】
试题分析:(1)摩尔盐(NH4)2Fe(SO4)2·6H2O铁的化合价为+2价,水溶液为浅绿色;(2)水溶液中亚铁离子水解,但摩尔盐中铵根离子水解抑制亚铁离子水解,相同浓度的盐溶液其亚铁离子浓度高,反过来c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是硫酸亚铁;(3)摩尔盐中铵根离子与强碱反应生成氨气,实验测定氨气的体积计算摩尔盐的浓度,氨气易溶于水,使产生的氨气不能完全逸出;(4)该实验是通过测定生成氨气的质量测定摩尔盐的纯度,故应先除掉氨气中的水蒸气,再用酸溶液吸收;因为氨气极易溶解于水会产生倒吸,故用球形干燥管防止;
n((NH4)2Fe(SO4)2·6H2O)=1/2 n(NH3)=0.68÷17÷2=0.02mol
m((NH4)2Fe(SO4)2·6H2O)= 0.02×392=7.84g
纯度为7.84÷10.0=0.784
考点:考查化学实验的定性和定量分析有关问题。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
(14分) 草酸亚铁用作分析试剂及显影剂等,其制备流程如下:
⑴配制(NH4)2Fe(SO4)26H2O溶液时,需加少量稀硫酸,目的是 。
⑵将制得的产品在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。
①则C处时残留物的化学式为 。
②有研究学者在实验过程中用气相色谱还检出H2,最终产 物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实: 。
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g)Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
(3)金属镁在国民生产中有重要作用,常以MgCl2为原料获取,温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。结合右图请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是 ;若要得到无水MgCl2须采取的措施是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年贵州省高三上学期期末考试化学试卷(解析版) 题型:填空题
(12分)下列三个反应在某密闭容器中进行:
反应①
Fe(s)+CO2(g) FeO(s)+CO(g) △H1="
a" kJ·mol-1
FeO(s)+CO(g) △H1="
a" kJ·mol-1
反应②
2CO(g)+O2(g) 2CO2(g) △H2=" b"
kJ·mol-1
2CO2(g) △H2=" b"
kJ·mol-1
反应③
2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1)则△H3= (用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.再通入CO2
C.升高温度 D.使用合适的催化剂
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为: 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三下学期质量检测(三)化学试卷(解析版) 题型:填空题
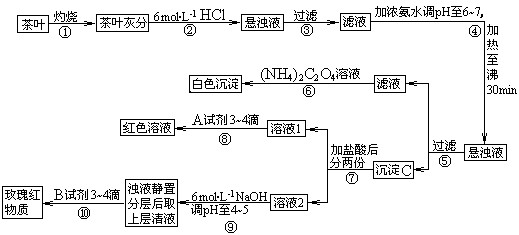
(14分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
[查阅部分资料]:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 _________________________________________ ;
(2)写出检验Ca2+的离子方程式 ___________________________;
(3)写出沉淀C所含主要物质的化学式 _____________________________;
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式_____________________________;
(5)步骤⑨的作用是 ;
(6)猜测步骤⑩的目的是 _________________________________ ;
(7)已知:2Fe (s)+ 3/2O2 (g)= Fe2O3(s),△H = — Q1 kJ·mol-1
2Al(s) + 3/2O2 (g)= Al 2O3(s),△H = — Q2 kJ·mol-1
则Q1 ___________Q2 (填“>”, “<”或“=”)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三4月双周练习化学试卷(解析版) 题型:填空题
(14分) 草酸亚铁用作分析试剂及显影剂等,其制备流程如下:

⑴配制(NH4)2Fe(SO4)2 6H2O溶液时,需加少量稀硫酸,目的是
。
6H2O溶液时,需加少量稀硫酸,目的是
。
⑵将制得的产品在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。

①则C处时残留物的化学式为 。
②有研究学者在实验过程中用气相色谱还检出H2,最终产 物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实: 。
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g) Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
(3)金属镁在国民生产中有重要作用,常以MgCl2为原料获取,温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。结合右图请回答下列问题:

①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是 ;若要得到无水MgCl2须采取的措施是 。
查看答案和解析>>
科目:高中化学 来源:江苏省2010届高三年级第一次模拟考试化学试题 题型:选择题
下列溶液中有关微粒的物质的量浓度关系正确的是
A.pH=4的0.1 mol·L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-)
B.NaHSO3和NaHCO3两溶液混合呈中性的溶液中(S和C均用R表示):
c(Na+)=c(HRO3-)+2c(RO32-)
C.常温下,等物质的量浓度的三种溶液:①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2中c(NH4+):①<③<②
D.常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:
c(Na+)>c(Cl—)=c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com