
为探究Fe(No3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究:
【查阅资料】2KNO3 2KNO2↑+O2↑ Fe(NO3)2
2KNO2↑+O2↑ Fe(NO3)2 FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑
实验一:探究Fe(NO3)2热分解固体产物中Fe元素的价态.该小组甲同学将分解后的固体产物溶于足量的稀 H2SO4得到相应两份溶液,进行以下探究实验.
(1)【提出猜想】
猜想一:Fe元素只显+2价;
猜想二:Fe元素______;
猜想三:Fe元素既有+2价又有+3价.
【实验操作】①向一份溶液中滴入KSCN溶液;②向另一份溶液中滴入酸性KMnO4稀溶液.
(2)【实验现象】实验①______;实验②______.
(3)【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是______.
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质.小组乙同学进行了如下实验,请完成实验空缺部分内容.限选试剂和用晶:浓 H2SO4%溶液、4mol/LNaOH溶液、0.1mol/LBaC12溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量Fe(NO3)2固体于试管中, 加热分解. | ______, 说明分解产生的气体中含NO2. |
| 步骤2:将产生的气体依次通过盛有足量 ______、浓硫酸的洗气瓶, ______在最后一个出口检验. | ______, 说明分解产生的气体中含 O2. |
实验三:
(5)KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:
①取混合物样品 10g,充分加热分解;
②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为 3.2g. 则混合物中铁元素的含量为______.
 2Fe2O3+4NO2↑+11O2↑,故答案为:4Fe(NO3)3
2Fe2O3+4NO2↑+11O2↑,故答案为:4Fe(NO3)3 2Fe2O3+4NO2↑+11O2↑;
2Fe2O3+4NO2↑+11O2↑; 2Fe2O3+8NO2+O2,KNO2溶解于水了、洗涤、干燥后剩下3.2克就全部是Fe2O3,其含铁也就是混合物的铁含量:3.2×
2Fe2O3+8NO2+O2,KNO2溶解于水了、洗涤、干燥后剩下3.2克就全部是Fe2O3,其含铁也就是混合物的铁含量:3.2×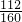 =
=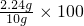 %=22.4%,故答案为:22.4%;
%=22.4%,故答案为:22.4%; 2Fe2O3+8NO2+O2,KNO2溶解于水了、洗涤、干燥后剩下3.2克就全部是Fe2O3,再根据质量百分数来计算;
2Fe2O3+8NO2+O2,KNO2溶解于水了、洗涤、干燥后剩下3.2克就全部是Fe2O3,再根据质量百分数来计算;

 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:阅读理解
| △ |
| △ |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量Fe(NO3)2固体于试管中, 加热分解. |
说明分解产生的气体中含N02. |
| 步骤2:将产生的气体依次通过盛有足量 |
说明分解产生的气体中含 02. |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省赣州市高三上学期期末联考理综化学试卷(解析版) 题型:实验题
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同。
(1)K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2;
(3)Hg以后不活泼金属的硝酸盐分解生成金属单质、NO2和O2。
2KNO3 2KNO2↑+O2↑
2KNO2↑+O2↑
2Cu(NO3)2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将其溶于足
量的稀H2SO4得到相应两份溶液,进行以下探究实验。
【提出猜想】猜想一:Fe元素只显+2价;
猜想二:Fe元素只显+3价;
猜想三:Fe元素____ _____。
【实验操作】①向一份溶液中滴入KSCN溶液②将稀酸性KMnO4溶液中滴入另一份溶液
【实验现象】实验① ;实验② 。
【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是 。
【实验二】探究Fe(NO3)2热分解气体产物的性质。小组乙、丙同学进行了如下图所示的实验(收集时操作恰当,几乎没有空气)

实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管,并重
新连接好仪器;④加热;⑤……
(1)乙同学使用A装置收集气体,恰好收集到常温常压下27mL的红棕色气体,为确保数据的准确性,读数时必须 。
(2)乙同学用带火星木条检验量筒内气体时,发现木条燃烧,且颜色变浅甚至无色,下列判断中正确的是 。
a.气体中只有NO2 b.气体是O2、NO2的混合物
c.支持燃烧的气体只有O2 d.NO2支持燃烧
(3)丙同学取等质量的Fe(NO3)2使用B装置收集气体,可收集到 mL气体。
【实验三】探究固体混合物的成分。小组丁同学取KNO3、Cu(NO3)2、Fe(NO3)2的混合粉末充分加热后用排水法未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是( )
A.1:2:2 B.2:1:3 C.1:2:3 D.3:8:6
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省佛山市高三教学质量检测(一)理综化学试卷(解析版) 题型:实验题
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究:
【查阅资料】2KNO3 2KNO2+O2↑
Fe(NO3)2
2KNO2+O2↑
Fe(NO3)2 FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑
实验一:探究Fe(NO3)2热分解固体产物中铁元素的价态。该小组甲同学将分解后的固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。
(1)【提纯猜想】
猜想一:铁元素只显+2价;
猜想二:铁元素 ;
猜想三:铁元素既有+2价又有+3价。
【实验操作】①向一份溶液中滴入KSCN溶液;向另一份溶液中滴入酸性KMnO4稀溶液。
(2)【实验现象】实验① ;实验② 。
(3)【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是 。
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质。小组乙同学进行料如下实验,请完成实验空缺部分内容。限选试剂和用品:浓H2SO4溶液、4mol/LNaOH溶液、0.1mol/LBaCl2溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量Fe(NO3)2固体于试管中,加热分解。 |
,说明分解产生的气体中含有NO2。 |
|
步骤2:将产生的气体依次通过盛有足量 、浓硫酸的洗气瓶, 在最后一个出口检验。 |
,说明分解产生的气体中含O2。 |
实验三:KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:①取混合物样品10g,充分加热分解;②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为3.2g。则混合物中铁元素的质量分数为 。(保留三位有效数字,相对原子质量:Fe-56 O-16)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省泰安市高三12月质检化学试卷(解析版) 题型:推断题
(10分)为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同
(1)K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2。
2KNO3 2KNO2↑+O2↑ 2Cu(NO3)2
2KNO2↑+O2↑ 2Cu(NO3)2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将其溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。
【提出猜想】
猜想一:Fe元素只显+2价;
猜想二:Fe元素只显______价;
猜想三:Fe元素_________。
【实验操作】①向一份溶液中滴入KSCN溶液;②稀酸性KMnO4溶液中滴入另一份溶液。
【实验现象】实验① ;
实验② 。
【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是 。
【实验二】探究Fe(NO3)2热分解气体产物的性质。小组乙、丙同学进行了如下图所示的实验(收集时操作恰当,几乎没有空气)

实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管,并重新连接好仪器;④加热;⑤……
(1)乙同学使用A装置收集气体,恰好收集到27mL红棕色气体,要从水槽中取出量筒,乙同学的正确操作方法是
。
(2)乙同学用带火星木条检验量筒内气体时,发现木条燃烧,下列判断中正确的是 。
a.气体中只有NO2 b.气体是O2、NO2的混合物
c.支持燃烧的气体只有O2 d.NO2支持燃烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com