
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
Ⅰ.Ni(S)+4CO(g)
 Ni(CO)4(g)+Q
Ni(CO)4(g)+Q
Ⅱ.Ni(CO)4(g) 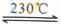 Ni(S)+4CO(g)
Ni(S)+4CO(g)
完成下列填空:
(1)在温度不变的情况下,要提高反应Ⅰ中Ni(CO)4的产率,可采取的措施有_______________________、____________________________。
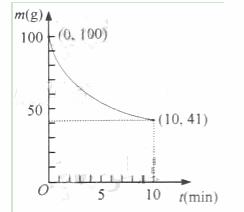
(2)已知在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如右图所示。Ni(CO)4在0~10min的平均反应速率为_______________________________。
(3)若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时,下列说法正确的是___________。
a.平衡常数K增大 b.CO的浓度减小 c.Ni的质量减小 d.v逆[Ni(CO)4]增大
科目:高中化学 来源: 题型:
下列中各组性质的比较,正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②离子还原性:S2->Cl->Br ->I- ③沸点:HF>HCl>HBr>HI
④金属性:K>Na>Mg>Al ⑤气态氢化物稳定性:HF>HCl>H2S ⑥半径:O2->Na+>Na>Cl
A、①②③ B、②③④ C、①④⑤ D、①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂。制备硝基苯的组装如下图反应装置,过程如下:

步骤:取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入恒压漏斗中。把18 mL苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。
③在50-60℃下发生反应,直至反应结束。
④将反应后的液体依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 。
(2)恒压滴液漏斗的优点是 。
(3)实验装置中长玻璃管可用 代替(填仪器名称)。
(4)反应结束后产品在液体的 层(填“上”或者“下”),分离混酸和产品的操作方法为 。
(5)为了得到更纯净的硝基苯,还须先向液体中加入 除去水,然后蒸馏。
(6)写出制备硝基苯的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列事实:(1)X+Y2+ = X2++Y;(2)Z+2H2O = Z(OH)2+H2  (3)Z2+氧化性比X2+弱;(4)由Y、W电极组成的原电池,电极反应为:W2++2e- = W,Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序是( )
(3)Z2+氧化性比X2+弱;(4)由Y、W电极组成的原电池,电极反应为:W2++2e- = W,Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序是( )
A、X>Z>Y>W B、Z>W>X>Y C、Z>X>Y>W D、Z>Y>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
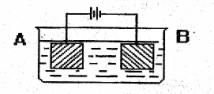
按图示装置进行实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增0.03g,则合金中Cu、Zn原子个数比为( )
A、4:1 B、3:1 C、2:1 D、任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到预期目的的是( )
A.通过电泳实验证明胶体带电
B.通常利用丁达尔效应区别溶液与胶体
C.渗析实验说明胶体粒子能透过半透膜
D.向煮沸的NaOH溶液中滴加FeCl3溶液可制备Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.Cl2通入水中:Cl2+H2O===2H++Cl-+ClO-
B.双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-===I2+2H2O
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O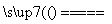 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.Na2S2O3溶液中加入稀硫酸:2S2O +4H+===SO
+4H+===SO +3S↓+2H2O
+3S↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
环境污染已成为人类社会面临的重大威胁,下列对应关系不正确的是
| 环境问题 | 造成环境问题的主要物质 | |
| A | 酸雨 | 二氧化硫 |
| B | 温室效应 | 二氧化碳 |
| C | 白色污染 | 二氧化硅 |
| D | 光化学烟雾 | 二氧化氮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com