
| A、上述反应中氧化剂和还原剂的物质的量之比为6:5 |
| B、产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾) |
| C、上述反应中消耗2molP时,转移电子的物质的量为15mol |
| D、因红磷和白磷互为同位素,所以上述火药中的红磷可以用白磷代替 |


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
| A、2 mol SO2+1 mol O2 |
| B、4 mol SO2+1 mol O2 |
| C、2 mol SO2+1 mol O2+2 SO3 |
| D、3 mol SO2+0.5 mol O2+1 SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属单质与盐溶液的反应都是置换反应 |
| B、加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾难溶于水 |
| C、与强酸、强碱都反应的物质只有两性氧化物和两性氢氧化物 |
| D、氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
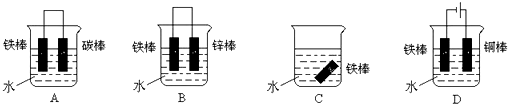
查看答案和解析>>
科目:高中化学 来源: 题型:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl固体中含有共价键 | ||||||
| B、CO2分子中含有离子键 | ||||||
C、
| ||||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H3PO4?T3H++PO43- |
| B、HCO3-+H2O?H3O++CO32- |
| C、CH3COONH4?CH3COO-+NH4+ |
| D、NaHS═Na++H++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
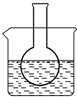 三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验:
三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com