
| A��2 LҺ̬ˮ�ֽ��2L������1L��������571.6kJ���� |
| B��2 mol������1mol������Ӧ����2mol��̬ˮ�ų���������571.6kJ |
| C������ͬ�����£�2 mol������1mol�����������ܺʹ���2molҺ̬ˮ������ |
| D��ʹ�ô����ܽ��÷�Ӧ�Ļ��ʹ��Ӧ�ų�������С��571.6kJ |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A��ʢ����Һ�ĵζ���������ˮϴ�Ӻ�δ�ñ�Һ��ϴ��װҺ�ζ� |
| B����ƿ������ˮϴ�Ӻ�δ�ô���Һ��ϴ |
| C����ȡ��Һ����ʱ���ζ�ǰƽ�ӣ��ζ����յ���� |
| D���ζ�ǰ�ζ��ܼ��촦������δ�ų����ζ���������ʧ |
| A��������ƽ | B����Ͳ |
| C����ʽ�ζ��� | D����ʽ�ζ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����д�Ȼ�ѧ����ʽʱ����Ҫע����Ӧ����������״̬������Ҫע����Ӧ�������¶Ⱥ�ѹǿ |
| B��HCl��NaOH��Ӧ���к��ȡ�H����57��3kJ��mol����H2SO4��Ca��OH��2��Ӧ���к���Ϊ��H��2������57��3��kJ��mol |
| C��ͬһ��ѧ��Ӧ��ѧ��������ͬ����Hֵ��ͬ����ѧ��������ͬ��״̬��ͬ����HֵҲ����ͬ |
| D����ͬ�����£���ѧ��Ӧ���������ջ�ų���������μӷ�Ӧ�����ʵ����ʵ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��
�� ��ʵ����N��N������Ϊ167kJ��mol��1��NO2�е���˫����ƽ������Ϊ466 kJ��mol��1��N2O4�е���˫����ƽ������Ϊ438.5 kJ��mol��1��
��ʵ����N��N������Ϊ167kJ��mol��1��NO2�е���˫����ƽ������Ϊ466 kJ��mol��1��N2O4�е���˫����ƽ������Ϊ438.5 kJ��mol��1�� N2O4 (g)�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����( )
N2O4 (g)�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����( )
| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
 N2O4(g)�÷�Ӧ��ƽ�ⳣ��K��ֵΪ ����100��ʱ��ijʱ�̲��c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L�����ʱ�̵�v�� ���� v�����>������<����=�����������¶Ⱥ�Ӧ2NO2
N2O4(g)�÷�Ӧ��ƽ�ⳣ��K��ֵΪ ����100��ʱ��ijʱ�̲��c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L�����ʱ�̵�v�� ���� v�����>������<����=�����������¶Ⱥ�Ӧ2NO2 N2O4��ƽ�ⳣ��K�� �����������С�����䡱����
N2O4��ƽ�ⳣ��K�� �����������С�����䡱�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��S(g)+O2(g)=SO2(g)��H1��S(s)+O2(g)=SO2(g)��H2�� ����H1>��H2 |
| B��C(ʯī��s)=C(���ʯ��s)��H=+1.9kJ/mol������ʯī��ȡ���ʯ�ķ�Ӧ�����ȷ�Ӧ�����ʯ��ʯī�ȶ� |
| C��NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ��H=-57.4kJ/mol����20gNaOH����Һ��ϡ������ȫ��Ӧ���ų�������Ϊ28.7kJ |
| D��CaCO3(s)=CaO(s)+CO2(g)��H>0����S>0���÷�Ӧ�κ��¶��¶����Է����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2(g) ��H="-437.3" kJ��molһ1
CO2(g) ��H="-437.3" kJ��molһ1 O2(g)
O2(g)  H2O(g) ��H ="-285.8" kJ��molһ1
H2O(g) ��H ="-285.8" kJ��molһ1 O2(g)
O2(g)  CO2(g) ��H ="-283.0" kJ��molһ1
CO2(g) ��H ="-283.0" kJ��molһ1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
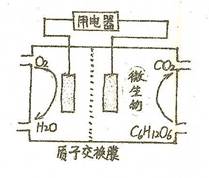
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com