
某溶液可能存在Na+、Ba2+、Mg2+、Fe3+、Br-、CO32-、Cl-等离子,某学生进行下列实验:取少量原溶液,测得溶液呈强碱性,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色。关于该原溶液的推测正确的是( )
A.溶液中可能存在Mg2+和Fe3+ B.溶液中可能存在Br-和Cl-
C.溶液可能存在Ba2+和Cl- D.溶液中一定存在Na+和CO32-
科目:高中化学 来源:2016-2017学年河北省卓越联盟高二上第一次月考化学试卷(解析版) 题型:选择题
在一密闭容器中进行以下可逆反应:M(g)+N(g) P(g)+2L在不同的条件下P的百分含量P %的变化情况如图,则该反应( )
P(g)+2L在不同的条件下P的百分含量P %的变化情况如图,则该反应( )
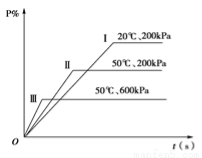
A.正反应放热,L是固体
B.正反应放热,L是气体
C.正反应吸热,L是气体
D.正反应放热,L是固体或气体
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上第一次阶段考化学试卷(解析版) 题型:选择题
下列有关实验操作、现象、解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 将灼烧变黑的热铜丝插入装少量无水乙醇的试管中 | 铜丝变红 | 乙醇具有氧化性 |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3?H2O能大量共存 |
C | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
D | 用硫酸做催化剂的淀粉水解液中,加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉未发生水解 |
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上第一次月考化学试卷(解析版) 题型:推断题
[选做题——有机化学基础]
高分子材料PET聚酯树脂和PMMA的合成路线如下:
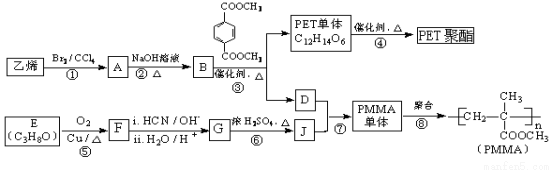
已知:
Ⅰ. RCOOR′+ R″18OH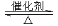 RCO18OR″+R′OH(R、R′、R″代表烃基)
RCO18OR″+R′OH(R、R′、R″代表烃基)
Ⅱ. 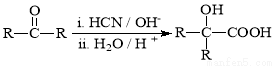 (R、R′代表烃基)
(R、R′代表烃基)
(1)G的官能团名称是___________、____________。
(2)②的化学方程式为 。
(3)⑥的反应类型是___________________________。
(4)J的某种同分异构体与J具有相同官能团,其结构简式是 。
(5)PMMA单体的结构简式为____________________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
(7)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上第一次月考化学试卷(解析版) 题型:选择题
使相同物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-  离子完全沉淀时,若所用相同浓度的AgNO3溶液的体积比为2:2:1,则上述三种溶液的体积比是( )
离子完全沉淀时,若所用相同浓度的AgNO3溶液的体积比为2:2:1,则上述三种溶液的体积比是( )
A.9:3:1 B.3:2:1 C.6:3:1 D.9:4:1
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上第一次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.7.8gNa2O2中含有的阴离子数是0.2 NA
B.常温常压下,8 g O2含有的电子数是4NA
C.标准状况下,2.24 L CCl4中含有的分子数为0.1NA
D.1 L 1.0 mol·L-1 Na2CO3溶液中含有的氧原子数为3NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省曲靖市高二上第一次月考化学卷(解析版) 题型:填空题
CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890.3 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用而产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量____________(填“>”、“<”或“=”)890.3 kJ。
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2= 2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:

①上图(所有物质均为气态)能表示该反应过程中能量变化的是__________(填字母)。
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图所示,则CH4的转化 率为 。
率为 。
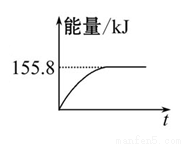
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH= 。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_____________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.将固态碳合成为C60,以C60作为燃料
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
在1.0 L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g) Y(g)+Z(g) ?H<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是
Y(g)+Z(g) ?H<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是

A.从反应开始到t1时的平均反应速率
v(X)= mol/(L·min)
mol/(L·min)
B.该温度下此反应的平衡常数K=0.32
C.欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量
D.其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上第一次大考化学卷(解析版) 题型:填空题
研究NO2、SO2、CO 等大气污染气体的处理具有重要意义。
等大气污染气体的处理具有重要意义。
(1)利用反应6NO2+8NH3 7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状
7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状 况下是________L。
况下是________L。
(2)已知:2SO2(g)+O2(g) ?2SO3(g) ΔH=-196.6kJ·mol-1
2NO(g)+O2(g)?2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=___________kJ·mol-1。
SO3(g)+NO(g)的ΔH=___________kJ·mol-1。
一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=___________。
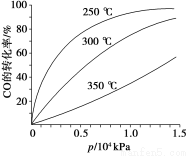
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应ΔH___________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是__________________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应ΔH___________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com