
| A. | 氘(D)原子核外有2个电子 | B. | 1H与D互称同位素 | ||
| C. | H2与D2互称同素异形体 | D. | 18g D2O的物质的量为1mol |
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:多选题
| A. | 葡萄糖和蔗糖 | B. | 蔗糖和麦芽糖 | ||
| C. | 甲酸甲酯(HCOOCH3)和乙酸(CH3COOH) | D. | 淀粉和纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

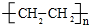 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “液氯”是纯净物而“氯水”是混合物 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | NO2溶于水发生了氧化反应,它既是氧化剂又是还原剂 | |
| D. | 用玻璃棒分别蘸取浓盐酸和浓氨水并互相靠近,能看到白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在如图所示的物质转化关系中(部分反应条件及产物省略),化合物A由短周期元素组成,所含离子数目比为1:2;B是常见的无色液体,C是能使湿润的红色石蕊试纸变蓝色的气体,E是淡黄色粉末,D、F、G均为无色气体.
在如图所示的物质转化关系中(部分反应条件及产物省略),化合物A由短周期元素组成,所含离子数目比为1:2;B是常见的无色液体,C是能使湿润的红色石蕊试纸变蓝色的气体,E是淡黄色粉末,D、F、G均为无色气体.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同温同压下,相同体积的氟气和氩气所含的原子数相等 | |
| B. | 标准状况下,1.12 L NO与1.12 L O2的混合物中含有的原子数为0.2NA | |
| C. | 常温下,1L 0.1 mol•L-1 CuSO4溶液中含有的Cu2+数目为0.1NA | |
| D. | 25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

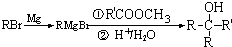 ②
②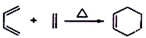
 .
.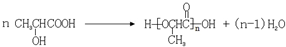 .
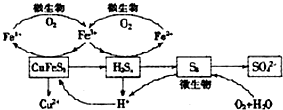
.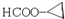 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、X元素在自然界中均不能以游离态存在,它们氧化物对应水化物的酸性依次递增 | |
| C. | 根据元素周期律推测,金属性T比Y强 | |
| D. | W、Z的最高价对应的氧化物熔化时破坏的作用力相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com