
| x |
| n |
| 3 |
| 2 |
| x |
| n |
| x |
| n |
| 3 |
| 2 |
| x |
| n |
| 3 |
| 2 |


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
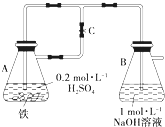 (1)如下图所示,当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:
(1)如下图所示,当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省高三第二次阶段考试化学试卷(解析版) 题型:填空题
(10分)已知:2Fe3++2I-===2Fe2++I2,2Fe2++Br2===2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________,被氧化的离子的物质的量分别是________。
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应的氧化产物的物质的量分别是________。
(3)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为________(用含a、b的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com