
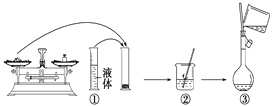
【题目】实验室需要配制0.50 mol/L NaCl溶液 240 mL,现使用NaCl固体配制, 按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平 药匙、烧杯、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体________g。
(3)称量。天平调平之后,应将天平的游码调至某个位置,请在下图中用一根 竖线标出游码左边缘所处的位置:______________
![]()
(4)将药品倒入烧杯中溶解、冷却。
(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯和玻璃棒2~3次是为了______________
(6)定容、摇匀。
(7)将配好的溶液倒入指定的试剂瓶,并贴好标签,注明溶液名称及浓度。
(8)配制时下列操作会导致所配溶液浓度偏高的是________。
A.转移时有少量溶液溅出 B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度 D.定容时液面超过了刻度线
E.称量NaCl时用了生锈的砝码
(9)下图是某同学在实验室配制该NaCl溶液的过程示意图,其中有错误的是________(填操作序号)。
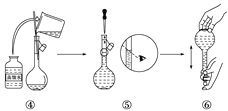
【答案】 250 mL容量瓶 胶头滴管 7.3 ![]() 保证溶质全部转移到容量瓶中 CE ①③⑤
保证溶质全部转移到容量瓶中 CE ①③⑤
【解析】试题分析:(1)根据配制一定物质的量浓度溶液的一般步骤,用到的仪器有:托盘天平(精确到0.1g)、药匙、等质量的两片滤纸、烧杯、玻璃棒、250mL容量瓶、胶头滴管。
(2)配制0.50mol/L NaCl溶液250mL,需要氯化钠的质量m="0.25L×0.50mol/L×58.5" g/mol=7.3g。
(3)根据上述计算,需要称取7.3g氯化钠固体,需要用5g砝码和2.3g游码,则游码的正确位置为![]() 。
。
(5)依据配制溶液的原理,必须将称取的溶质全部转移到容量瓶,而烧杯和玻璃棒上沾有溶质,所以需要洗涤烧杯和玻璃棒2~3次是为了保证溶质全部转移到容量瓶中。
(8)A.转移时有少量溶液溅出,导致溶质减少,所配溶液浓度偏低;B.容量瓶用蒸馏水洗净后未干燥对测定结果无影响;C.定容时俯视读取刻度,导致水加少了,所配溶液浓度偏高,D.定容时液面超过了刻度线,水加多了,导致所配溶液浓度偏低,E.称量NaCl时用了生锈的砝码,溶质增多,导致所配溶液浓度偏高,答案选CE。
(9)必须在烧杯中溶解固体,①错误;定容时,玻璃棒的末端应该抵在刻度线的下方,③错误;定容时平视刻度线,⑤错误;答案为①③⑤。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 制普通玻璃的主要原料是烧碱、石灰石、石英
B. SiO2是光导纤维的主要成分,晶体硅可用于制作半导体材料
C. 实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液
D. 盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯、铁的某些化合物在工业生产和生活中有着重要的作用。
(1)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。主要有两种制备方法:
方法一:
工业上常常用 KClO3和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 ,生成5molClO2转移电子 mol。
方法二:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
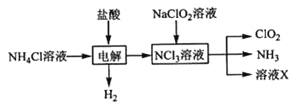
NCl3溶液和NaClO2溶液发生反应的离子方程式 。
X中大量存在的阴离子有_____ 。
(2)铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
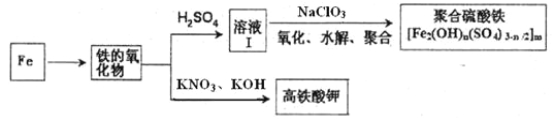
①检验固体铁的氧化物中铁的化合价,应使用的试剂是 (填标号)。
A.稀硫酸 B.稀硝酸 C.KSCN溶液 D.酸性高锰酸钾溶液
②在溶液Ⅰ中加入NaClO3写出其氧化Fe2+的离子方程式: 。
③Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸鉀。完成并配平化学方程式:
□Fe2O3+□KNO3+□KOH——□ +□KNO2+□ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。已知:
2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
(1)请回答:反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H= kJ/mol。
2Fe(s)+3CO2(g) △H= kJ/mol。
II.已知反应1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g)在1000℃的平衡常数K等于4.0 ,在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
2/3Fe(s)+CO2(g)在1000℃的平衡常数K等于4.0 ,在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
(2)该反应的平衡常数表达式为K=____________;CO的平衡转化率= _____________。
(3)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
III. 以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
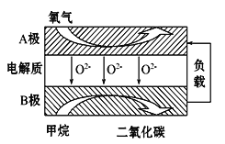
(4)B极上的电极反应式为 。
(5)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的体积为 L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质(括号内为杂质)的方法正确的是 ①乙烷(乙烯)光照条件下通入Cl2,气液分离②乙酸乙酯(乙酸)用饱和碳酸钠溶液洗涤、分液③苯(乙酸)用氢氧化钠溶液洗涤、分液④乙醇(乙酸)加足量生石灰、蒸馏
A. ①②③ B. ②③④ C. ①③④ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol.L-l的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是

A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA) +c (HB) +c (HD) =c (OH-) -c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一事实能说明生物界与非生物界具有统一性( )
A. 生物与非生物都具有化学变化
B. 生物与非生物都由元素构成
C. 组成生物体的化学元素在无机自然界中都可以找到
D. 生物与非生物都含有碳元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com