
| A.① | B.② | C.②③ | D.①②③ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.石墨比金刚石稳定 |
| B.金刚石比石墨稳定 |
| C.相同物质的量的石墨比金刚石的总能量高 |
| D.两者互为同位素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.热化学方程式的计量数可以表示分子的个数 |
| B.热化学方程式中只需标明生成物的状态 |
| C.反应热指的是反应过程中放出或吸收的热量 |
| D.伴随能量变化的一定是化学变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min) |
| D.反应吸收0.025Q kJ热量时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.①②③ | B.②③ | C.①② | D.①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
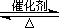 2SO3(g) ?H="-196.6" kJ·mol-1
2SO3(g) ?H="-196.6" kJ·mol-1 2NO2(g) ?H="-113.0" kJ·mol-1
2NO2(g) ?H="-113.0" kJ·mol-1  SO3(g)+NO(g)的?H= kJ·mol-1。
SO3(g)+NO(g)的?H= kJ·mol-1。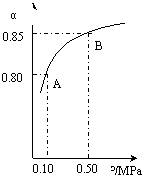
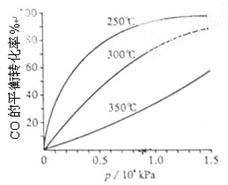
 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com