
【题目】钠、铝和铁是三种重要的金属。请回答:
(1)这三种金属中金属活动性最强的是______ (填元素符号)
(2)画出铝的原子结构示意图________ 。
(3)写出氯化铝的电离方程式________ 。
(4)把一小块金属钠投入水中,观察到以下各种现象:钠浮在水面上,熔成闪亮的小球,四处游动,逐渐减少,直至消失。写出该反应的化学方程式______;其中钠熔成闪亮小球的原因是_______。钠完全反应后,收集到标准状况下的氢气2.24L,则参加反应的钠的物质的量为______ mol。
(5)将(4)所得溶液平均分成两份:
①一份加入足量的铝片充分反应,写出该反应的离子方程式:___________。
②向另一份溶液中滴加FeCl3溶液至沉淀不再增加,写出生成沉淀的反应的离子方程式__________;继续将沉淀过滤、洗涤、干燥、灼烧,此时得到的固体为_____(填化学式)。
【答案】Na 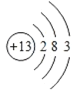 AlCl3=Al3++3Cl- 2Na+2H2O=2NaOH+H2↑ 钠的熔点较低,钠与水反应是放热反应,放出的热量使钠熔化,形成银白色小球 0.2 2Al+2OH -+2H2O=2AlO2-+3H2↑ Fe3++3OH-=Fe(OH)3↓ Fe2O3
AlCl3=Al3++3Cl- 2Na+2H2O=2NaOH+H2↑ 钠的熔点较低,钠与水反应是放热反应,放出的热量使钠熔化,形成银白色小球 0.2 2Al+2OH -+2H2O=2AlO2-+3H2↑ Fe3++3OH-=Fe(OH)3↓ Fe2O3
【解析】
(1)Na、Al、Fe,按照金属活动顺序表,越前面的金属,其活动性越强,这三种金属中,Na的排序最前,因此金属活动性最强的是Na;
(2)Al,为13号元素,其结构示意图为 ;
;
(3)AlCl3在水溶液中电离出Al3+和Cl-,则其电离方程式为AlCl3=Al3++3Cl-;
(4)金属钠和水发生反应生成NaOH和H2,化学方程式为2Na+2H2O=2NaOH+H2↑;钠的熔点较低,钠与水反应是放热反应,放出的热量使钠熔化,形成银白色小球。标准状况下的氢气2.24L,其物质的量为0.1mol,根据化学方程式,每生成1molH2消耗2molNa,生成0.1molH2,消耗0.2molNa;
(5)钠与水反应后的溶液为NaOH:
①Al和NaOH溶液反应,得到NaAlO2和H2,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
②FeCl3溶液与NaOH溶液反应,得到红褐色沉淀Fe(OH)3,离子方程式为Fe3++3OH-=Fe(OH)3↓;Fe(OH)3受热分解,得到Fe2O3。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、Q、R 的原子序数依次增大,X 的简单阴离子与锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q 的单质与稀硫酸剧烈反应生成 X 的单质。向100mLX2R的水溶液中缓缓通入RZ2 气体,溶液pH与RZ2 体积关系如下图。下列说法正确的是( )

A. X2R 溶液的浓度为0.03mol·L-1
B. 最简单气态氢化物的稳定性:Y>Z>R
C. 工业上通常采用电解法冶炼Q的单质
D. RZ2 通入 BaCl2、Ba(NO3)2 溶液中,均无明显现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知稀硝酸和铜能发生反应,生成硝酸铜、一氧化氮气体和水。
(1)请写出该反应的化学方程式,并用双线桥法标出反应中电子转移的方向和数目。________
(2)一次实验中,某同学用过量的稀硝酸(其密度为1.08 g·mL-1,HNO3的质量分数为12%)跟一定量的铜片反应,产生了标准状况下0.56 L的一氧化氮。试计算(简要写出计算过程):
①该稀硝酸的物质的量浓度(结果保留小数点后一位);______________
②被还原的HNO3的物质的量。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种不溶于水的固体。A是某元素的一种单质,它在氧气中完全燃烧得到一种无色气体,此气体能使澄清石灰水变浑浊,另外测得这种气体密度为同温、同压下氧气密度的1.375倍。B固体能溶于热氢氧化钠溶液,再往所得溶液中加入过量盐酸时,析出白色胶状沉淀D。此沉淀干燥后,成为不溶于水的白色粉末,这是一种比碳酸酸性还弱的酸。将B与石灰石、纯碱按比例混合加热得到C,C在高温时软化,无固定熔点。
(1)根据以上事实,形成单质A的元素名称为__, C的名称为__。
(2)B固体溶于热氢氧化钠溶液的化学方程式是__。
(3)生成白色胶状沉淀D的化学方程式是__。
(4)由B制取C的化学方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数和温度的关系如下:
C(g)+D(g)的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
现有两个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molA和1molB,在Ⅱ中充入1molC和1 molD,800℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中的压强相等B.容器Ⅰ、Ⅱ中反应的平衡常数相同
C.容器Ⅰ中C的体积分数比容器Ⅱ中的小D.容器Ⅰ中A的浓度比容器Ⅱ中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化反应:2SO2(g)+O2(g)![]() 2SO3(g)是工业制硫酸重要反应。
2SO3(g)是工业制硫酸重要反应。
(1)从平衡角度分析采用过量O2的原因是_____。
(2)某温度下,SO2的平衡转化率(![]() )与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)____K(B)(填“>”、“<”或“=”,下同)。
)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)____K(B)(填“>”、“<”或“=”,下同)。
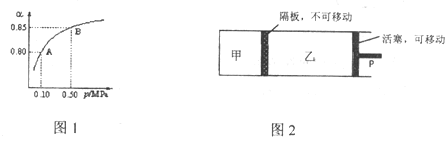
(3)保持温度不变,将等物质的量的SO2和O2混合气平分两份,分别加入起始体积相同的甲、乙两容器中,保持甲容器恒容,乙容器恒压到达平衡(如图2)。两容器的SO2的转化率关系为![]() 甲_____
甲_____![]() 乙。
乙。
(4)工业制硫酸的尾气中有少量SO2气体,可用NaClO2碱性溶液吸收,该反应的离子方程式为:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
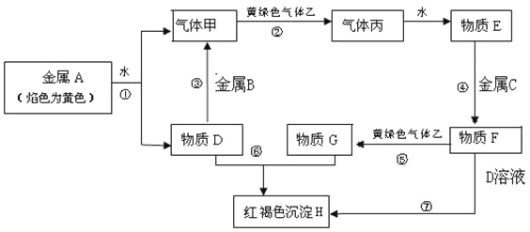
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A_______、F________、H________。
(2)反应过程⑦可能观察到的实验现象______,反应的化学方程式为④_________。
(3)反应⑤的离子方程式为__________。
(4)反应①-⑦的7个反应属于氧化还原反应反应的有 ________(填选项代号)。
A.①②④⑤⑥ B.②③④⑥⑦ C.①②③④⑤⑦ D.全部
(5)向纯碱溶液中通入气体乙,可制得某种生产生活中常用的漂白、消毒的物质,同时有小苏打生成。该反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A. 单位时间内生成n molA2同时生成n molAB
B. 容器内的总物质的量不随时间变化
C. 单位时间内生成2n molAB的同时生成n molB2
D. 单位时间内生成n molA2的同时生成n molB2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业利用含镍废料(以镍铁钙合金为主)制取NiC2O4(草酸镍),再经高温煅烧NiC2O4制取Ni2O3的流程如图:
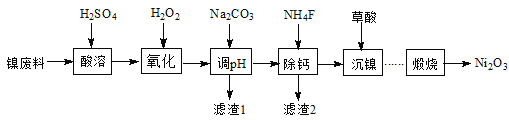
已知:NiC2O4、CaC2O4均难溶于水;Fe3+完全沉淀的pH约为3.2。
(1)“酸溶”时硫酸不宜过多的原因为________。
(2)加入H2O2发生的主要反应的离子方程式为________;
(3)加入Na2CO3溶液调节pH至4.0~5.0,其目的为_________。
(4)加入NH4F溶液可将Ca2+转化为CaF2沉淀除去,已知25℃时Ksp(CaF2)=1.6×10-10,要使溶液中Ca2+沉淀完全[c(Ca2+)≤1.0×10-5 mol·L-1],则“除钙”时需控制NH4F的浓度至少为_______mol·L-1。
(5)NiC2O4隔绝空气高温煅烧可制得Ni2O3,NiC2O4受热分解的化学方程式为_____。
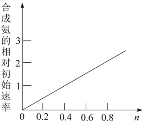
(6)Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时,合成氨的相对初始速率随催化剂中n值变化的曲线如图,由图可知Co2+、Ni2+两种离子中催化效果更好的是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com