氮是大气中含量十分丰富的一种元素,氮及其化合物在生产、生活中有着重要应用。氮氧 化物会导致环境污染,生产中需要严格治理有关污染。请回答下列问题。
(1)据报道,意大利科学家获得了极具研究价值的N
4,其分子结构与白磷分子的正四面体结构相似。已知断裂1 mol N-N键吸收167 kJ的热量,生成1 mol N三N键放出942 kJ的热量,请写出N
4转变为N
2的反应的热化学方程式:___。
(2)已知NH
3在氧气中燃烧可生成N
2和水。据报道,NH
3可直接用作车用碱性燃料电池,写出该电池的负极反应式:____。
(3)已知:温度低于21.15 ℃时,NO
2几乎全部转变为N
2O
4。工业上可用N
2O
4与水反应来提高硝酸的产率。N
2O
4与氧气在冷水中生成硝酸的化学方程式为___。
(4)工业上可用Na
2CO
3溶液吸收NO
2,该反应的化学方程式为2NO
2+Na
2CO
3=NaNO
2+___ +____。
(5)一定条件下,某密闭容器中N
2O
4和NO
2的混合气体达到平衡时,c(NO
2)=0.50 mol/L、 c(N
2O
4) =0.125 mol/L。则该条件下2NO
2(g)
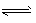
N
2O
4(g)的平衡常数K=___,若NO
2的起始浓度为2 mol/L,且初始时无N
2O
4,其他条件保持不变,则NO
2的最大转化率为___。

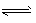 N2O4(g)的平衡常数K=___,若NO2的起始浓度为2 mol/L,且初始时无N2O4,其他条件保持不变,则NO2的最大转化率为___。
N2O4(g)的平衡常数K=___,若NO2的起始浓度为2 mol/L,且初始时无N2O4,其他条件保持不变,则NO2的最大转化率为___。  阅读快车系列答案
阅读快车系列答案