
下列有关实验原理、方法和结论都正确的是( )
A.用HNO2溶液做导电性实验,灯光较暗,说明HNO2是弱电解质
B.在滴有酚酞的Na2CO3溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡
C.将等体积、等pH的盐酸和醋酸溶液分别稀释相同倍数,醋酸溶液的pH变化大
D.利用溶解性的不同,可用酒精将碘水中的碘萃取出来
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是
A.R一定是共价化合物 B.R一定是离子化合物
C.R可能是共价化合物,也可能是离子化合物
D.R可能是气态物质,也可能是固态物质
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列操作中,一般情况下不能相互接触的是( )
A.过滤时,玻璃棒与三层滤纸
B.分液时,分液漏斗下端与烧杯内壁
C.过滤时,烧杯内壁与漏斗下端
D.用胶头滴管向试管内滴加液体时,胶头滴管尖端与试管内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
在电子工业中,制作电路时,常用氯化铁溶液作为铜的腐蚀液,该过程发生的反应为:2FeCl3 + Cu == 2FeCl2 + CuCl2。该反应利用了铜的性质中的
A.氧化性 B.还原性
C.导电性 D.导热性
查看答案和解析>>
科目:高中化学 来源: 题型:
营养平衡、合理用药是保证人体健康和生活质量的重要途径。
(1)人体需要的营养素主要有糖类、 、蛋白质、无机盐、维生素和水。人们每天摄取的热能中大约有75%来自糖类,淀粉是一种重要的多糖,它在人体内水解的最终产物是 (填分子式)。维生素C能防治坏血病并具有还原性,验证维生素C有还原性可以使用淀粉溶液和 (填试剂名称)共同完成。
(2)下列物质中,具有解热镇痛疗效的是 (填字母,下同),治疗胃酸过多的是 。
a.氨基酸 b.阿司匹林 c.青霉素 d.复方氢氧化铝
(3)在食品加工或餐饮业中,特别要严加控制用量的物质是 (填字母)。
a.氯化钠 b.碳酸氢钠 c.亚硝酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
亚硫酸盐是一种常见食品添加剂。为检测某食品中亚硫酸盐含量(通常以1 kg样品中含SO2的质量计)。某研究小组设计了如下两种实验流程:
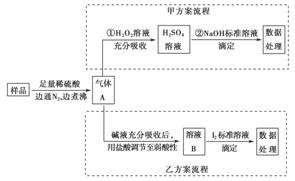
(1)气体A的主要成分是________。为防止煮沸时发生暴沸,必须先向烧瓶中加入________;通入N2的目的是________。
(2)写出甲方案第①步反应的离子方程式:________________________。
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是__________________________________________________________。
(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果________(填“偏高”“偏低”或“无影响”)。
(5)若取样品w g,按乙方案测得消耗0.010 00 mol·L-1I2溶液V mL,则1 kg样品中含SO2的质量是________g(用含w、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤对电子数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是____________(写分子式),它们的稳定性由弱到强的顺序是_______________________________________________________(写分子式)。
(3)分子ABC、BA2D的空间构型分别是________、________。
(4)B、C、D三种元素的电负性由大到小的顺序是________(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)C的单质分子中存在________个π键、________个σ键。
查看答案和解析>>
科目:高中化学 来源: 题型:
I、有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中除稀有气体外电负性最小的元素 |
(1)B原子最外层共有 种不同运动状态的电子,
(2)C的第一电离能比F 的 (填“大”或“小”),
(3)D与E可形成 DE3分子,其 中心原子的杂化方式为 ,其空间构型为 。
II、原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满。下表是主要化合价及原子半径数据:
| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3 +5 | -2 +6 | -1 +7 | +2 | +1 +2 |
| 原子半径 | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
 (1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(2)F2+与NH3 形成配离子时提供空轨道的为 (填写微粒的化学式);往某种蓝色溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成深蓝色透明溶液,可得到含有上述配离子的配合物。写出沉淀溶解的离子方程式 。
(3)图中四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出字母C所对应元素的氢化物所在的折线 (填n、m、x或y)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com