
 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.分析 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子,核外电子排布式为1s22s22p2,则R为C元素;工业上通过分离液态空气获得X单质,结合原子序数可知X为O元素、W为N元素;Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和,三元素原子序数之和为6+7+8=21,则Y为Cl元素;Z基态原子的最外能层只有一个电子,其他能层均已充满电子,原子序数大于氯,处于第四周期,核外电子数为2+8+18+1=29,故Z为Cu.
解答 解:周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子,核外电子排布式为1s22s22p2,则R为C元素;工业上通过分离液态空气获得X单质,结合原子序数可知X为O元素、W为N元素;Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和,三元素原子序数之和为6+7+8=21,则Y为Cl元素;Z基态原子的最外能层只有一个电子,其他能层均已充满电子,原子序数大于氯,处于第四周期,核外电子数为2+8+18+1=29,故Z为Cu.
(1)Cu2+基态核外电子排布式为:1s22s22p63s23p63d9,
故答案为:1s22s22p63s23p63d9;
(2)ClO4-中Cl原子孤电子对数=$\frac{7+1-2×4}{2}$=0、价层电子对数=4+0=4,故其空间构型是正四面体,与ClO4-互为等电子体的一种分子含有5个原子、32个价电子,该分子为CCl4等,HClO4有 3 个非羟基氧,而 HClO2有 1 个非羟基氧,HClO4酸性比HClO2强,
故答案为:正四面体;CCl4等;HClO4有 3 个非羟基氧,而 HClO2有 1 个非羟基氧;
(3)结构简式为CO(N2H3)2的化合物中碳原子形成3个σ键,没有孤对电子,杂化轨道数目为3,碳原子的杂化轨道类型为sp2;
结构简式为O=C(NH-NH2)2,分子中含有11个σ键,1molRX(W2H3)2分子中含有σ键数目为11NA,
故答案为:sp2;11NA;
(4)往CuSO4溶液中通入过量的NH3,可生成[Cu(NH3)4]SO4,
A.[Cu(NH3)4]SO4中配离子与外界硫酸根之间形成离子键,铜离子与氨气分子之间形成配位键,氨气分子与硫酸根中含有极性键,故A正确;
B.在[Cu(NH3)4]2+中Cu2+提供空轨道,NH3给出孤对电子,故B错误;
C.非金属性越强,第一电离能越大,氮元素2p轨道为半满稳定状态,能量较低,第一电离能高于氧元素的,[Cu(NH3)4]SO4组成元素中第一电离能最大的是N元素,故C错误;
故选:A;
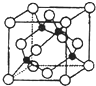
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子).
①晶胞中黑色球数目为4,白色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,该晶体的化学式为CuCl,
故答案为:CuCl;
②已知Z和Y的电负性分别为1.9和3.0,二者电负性之差小于1.7,则Y与Z形成的化合物属于共价化合物,
故答案为:共价;
③黑色球与周围的4个白色球相邻,形成正四面体结构,黑色球与晶胞顶点白色球连线处于晶胞体体对角线上,为二者距离为体对角线长度的$\frac{1}{4}$,而体对角线长度为晶胞棱长的$\sqrt{3}$倍,晶胞质量为4×$\frac{64+35.5}{N{\;}_{A}}$g,该晶体的密度为ρg.cm-3,则晶胞棱长为$\root{3}{\frac{4×\frac{64+35.5}{N{\;}_{A}}g}{ρg•cm{\;}^{-3}}}$=$\root{3}{\frac{4×99.5}{ρN{\;}_{A}}}$cm,故该晶体中Z原子和Y原子之间的最短距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρN{\;}_{A}}}$cm=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρN{\;}_{A}}}$×1010 pm,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρN{\;}_{A}}}$×1010.
点评 本题是对物质结构与性质的考查,为高考常见题型,侧重于学生的分析能力和计算能力的考查,题目涉及核外电子排布、空间构型与杂化方式判断、等电子体、分子结构与性质、化学键、电负性、晶胞计算等,(5)中原子距离计算为易错点、难点,需要学生具备一定的数学计算能力.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取气体时,先装药品,后检查装置的气密性 | |
| B. | 加热KClO3并用排水法收集O2实验结束时,先熄灭酒精灯,后移出导管 | |
| C. | 稀释浓硫酸时,先把浓硫酸倒入烧杯中,后沿器壁缓慢注入水,边加边搅拌 | |
| D. | 加热试管时,先使试管底部均匀受热,后用酒精灯的外焰固定加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝能置换出氧化铁中的铁,钢铁工业利用铝热反应冶炼铁 | |
| B. | 用铝制容器盛放浓硝酸,是因为铝和浓硝酸不反应 | |
| C. | 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用 | |
| D. | 因为液态氨气化时吸热,可用液态氨作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态碳原子的L层电子排布图: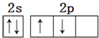 | |
| B. | 二氧化碳的电子式: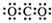 | |
| C. | 硫离子的结构示意图: | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉只有氢气产生的溶液中:Na+、SO42-、NO3-、Mg2+、 | |
| B. | 滴加石蕊试液显红色的溶液中:Fe3+、NH4+、Cl-、SCN- | |
| C. | 在0.1mol/L的NaHSO4溶液中:NH4+、Na+、Al3+、Cu2+、NO3- | |
| D. | 在0.1mol/L的NaHCO3溶液中K+、Al3+、Fe3+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com