
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4溶液与Na2CO3溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
(沉淀制备)取一定量胆矾(CuSO4·5H2O)溶于水,再滴几滴稀硫酸,充分搅拌后得到一定体积的CuSO4溶液。向其中加适量Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)用无水乙醇洗涤的目的是________。
(实验探究)同学们设计了如下装置,用制得的蓝绿色固体进行实验:
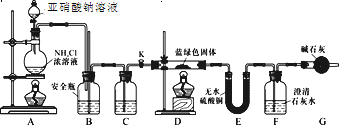
(2)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭K,点燃D处酒精灯。A中产生的N2将装置中的空气排除,避免干扰。C中盛装的试剂应是________。
(3)装置A中发生反应的离子方程式为________。
(4)若蓝绿色固体的组成为xCuCO3·yCu(OH)2,实验能观察到的现象是________。
(5)同学们查阅文献知:Ksp(CaCO3)=2.8×10-9,Ksp(BaCO3)=5.1×10-9,经讨论认为需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是________。
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(6)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是________。若定量分析所取蓝绿色固体质量为27.1 g,装置F中使用Ba(OH)2溶液,实验结束后,装置E的质量增加2.7 g,F中产生沉淀19.7 g。则该蓝绿色固体的化学式为________。
【答案】利用乙醇易挥发的性质带走沉淀上面的水浓硫酸NO2-+NH4+ ![]() N2↑+2H2O硬质玻璃管中蓝绿色固体变黑色,E中白色固体变蓝,F中溶液变浑浊b d让停留在装置中的气体被充分吸收,减小实验误差2CuCO3·3Cu(OH)2或3Cu(OH)2·2CuCO3或Cu5(OH)6(CO3)2
N2↑+2H2O硬质玻璃管中蓝绿色固体变黑色,E中白色固体变蓝,F中溶液变浑浊b d让停留在装置中的气体被充分吸收,减小实验误差2CuCO3·3Cu(OH)2或3Cu(OH)2·2CuCO3或Cu5(OH)6(CO3)2
【解析】
(1)乙醇易挥发,可带走沉淀上面的水,故答案为:利用乙醇易挥发的性质带走沉淀上面的水;
(2)进入D装置中的气体需要干燥,因此C瓶装浓硫酸,可以干燥氮气;故答案为:浓硫酸;
(3)A中的反应为亚硝酸根与铵根离子价态归中生成氮气,发生的离子方程式为:NO2-+NH4+ ![]() N2↑+2H2O;故答案为:NO2-+NH4+
N2↑+2H2O;故答案为:NO2-+NH4+ ![]() N2↑+2H2O;
N2↑+2H2O;
(4)若蓝绿色固体的组成为xCuCO3yCu(OH)2,则分解生成黑色氧化铜、水、二氧化碳,则硬质玻璃管中蓝绿色固体变黑色,E中白色固体变蓝,F中溶液变浑浊;故答案为:硬质玻璃管中蓝绿色固体变黑色,E中白色固体变蓝,F中溶液变浑浊;
(5)Ba(OH)2溶解度大于Ca(OH)2,充分吸收CO2,BaCO3的摩尔质量大于CaCO3,测量误差小;氢氧化钙为强碱,CaCO3的溶解度和BaCO3溶解度相差不大;故答案为:bd;
(6)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是让停留在装置中的气体被充分吸收,减小实验误差;E中吸收的是水,水的物质的量为![]() =0.15mol,F中吸收的是二氧化碳生成碳酸钡白色沉淀,根据碳原子守恒得二氧化碳的物质的量为
=0.15mol,F中吸收的是二氧化碳生成碳酸钡白色沉淀,根据碳原子守恒得二氧化碳的物质的量为![]() =0.1mol,氧化铜的物质的量=(271.g-2.7g-0.1mol×44g/mol)÷80g/mol═0.25mol,则铜离子、氢氧根离子和碳酸根离子的物质的量之比=0.25mol:0.3mol:0.1mol=5:6:2,所以其化学式为:2CuCO33Cu(OH)2或3Cu(OH)22CuCO3或Cu5(OH)6(CO3)2;故答案为:让停留在装置中的气体被充分吸收,减小实验误差;2CuCO33Cu(OH)2或3Cu(OH)22CuCO3或Cu5(OH)6(CO3)2。
=0.1mol,氧化铜的物质的量=(271.g-2.7g-0.1mol×44g/mol)÷80g/mol═0.25mol,则铜离子、氢氧根离子和碳酸根离子的物质的量之比=0.25mol:0.3mol:0.1mol=5:6:2,所以其化学式为:2CuCO33Cu(OH)2或3Cu(OH)22CuCO3或Cu5(OH)6(CO3)2;故答案为:让停留在装置中的气体被充分吸收,减小实验误差;2CuCO33Cu(OH)2或3Cu(OH)22CuCO3或Cu5(OH)6(CO3)2。


科目:高中化学 来源: 题型:
【题目】某有机反应中间体(M)的一种合成路线如图所示。



③标准状况下,气态烃A的密度是H2的14倍
④芳香族化合物H能发生银镜反应
请回答下列问题:
(1)B的名称(系统命名)为_____________ ;H→I的反应类型为___________;
(2)J中官能团的名称为_________,
(3)G→H的化学方程式为____________________________________________;
(4)D+J→M的化学方程式为__________________________________________;
(5)写出符合下列条件的J的所有同分异构体的结构简式________(不考虑立体异构)。
①苯环上连有-NO2 ②核磁共振氢谱有3个峰
符合以上条件的J的所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器是__________________(填选项字母)。
a.质谱仪 b.红外光谱仪 c.元素分析仪
(6)结合已有知识和相关信息,写出以CH3CHO和E为原料,经三步制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例为:
的合成路线流程图(无机试剂任用)。合成路线流程图示例为: _____________
_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H和I是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
①A、B、E、F、G能使湿润的蓝色石蕊试纸变红,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使湿润的石蕊试纸变色;
②A和I相遇产生白色烟雾;
③B和E都能使品红溶液褪色;
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟;
⑤将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
⑥C和D相遇生成红棕色气体;
⑦G在D中燃烧可以产生E和H2O;
⑧将B和H在瓶中混合后于亮处放置几分钟,瓶内壁出现油状液滴并产生A。
回答下列问题:
(1)A的化学式是__________,②中烟雾的化学式是______________;
(2)④中发生反应的化学方程式是____________________________________________;
(3)⑤中发生反应的化学方程式是_________________________________________;
(4)C的化学式是__________,D的化学式是__________;
(5)⑦中发生反应的化学方程式是____________________________________________;
(6)H的化学式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
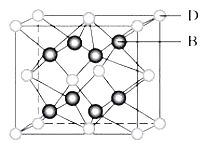
【题目】有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E正一价阳离子M能层电子已排满。D与B可形成离子化合物其晶胞结构如图所示。请回答下列问题:
(1)E元素原子基态时的价电子排布图为___________;
(2)A2F分子中F原子的杂化类型是_______,F的氧化物FO3分子空间构型为______;
(3)CA3极易溶于水,其原因主要是________,试判断CA3溶于水后形成CA3·H2O的合理结构________(填字母代号),从氢键的形成角度回答推理依据是:___________。
(a)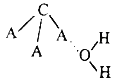 (b)
(b)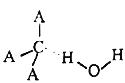
(4)E的晶胞常采取________堆积方式。
(5)从图中可以看出,D跟B形成的离子化合物的化学式为_________;该离子化合物晶体的密度为ag/cm3,则晶胞的体积是_______cm3(写出表达式即可,NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Se、Br两种元素的部分信息如图所示,下列说法正确的是
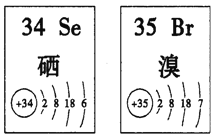
A. 原子半径:Br>Se>P B. 还原性:S2->Se2->Br-
C. SeO2既有氧化性又有还原性 D. 在Se2Br2分子中只含有极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是

A. 向NaAlO2溶液中逐渐滴入HCl至过量
B. 向澄清石灰水中通入SO2至过量
C. 向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列八种物质: ①铝 ②蔗糖 ③SiO2 ④H2SO4 ⑤NaOH ⑥FeSO4溶液 ⑦Ba(OH)2 ⑧氢氧化铁胶体。
(1)上述物质属于电解质的有____________(填序号,下同),能导电的有__________。
(2)上述物质中有两种物质在水溶液中反应的离子方程式为H++OH===H2O,则该反应的化学方程式为____________。
(3)实验室制备⑧的离子方程式为__________________。若在⑧中缓慢加入④的溶液,产生的现象是________________________。
(4)③是玻璃的主要成分之一,③与⑤溶液反应的化学方程式为_______________。工艺师常用_______(填物质名称)来雕刻玻璃。
Ⅱ.下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A.分液 B.过滤 C.萃取 D.蒸馏 E.蒸发结晶 F.高温分解
(1)分离CCl4和H2O:___________。
(2)除去澄清石灰水中悬浮的CaCO3: ___________。
(3)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com