
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 酸性HCl>H2S | 非金属性Cl>S |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | 向NaI溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈紫红色. | I-还原性强于Cl- |
| D | Na在Cl2中燃烧的生成物含离子键 | NaCl固体可导电 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.元素最高价氧化物的水化物酸性越强,其非金属元素的非金属性越强;
B.原电池反应是自发的氧化还原反应;
C.溶液上层呈紫红色,可知氯气氧化碘离子;
D.存在自由电子或自由移动的离子能导电.
解答 解:A.元素最高价氧化物的水化物酸性越强,其非金属元素的非金属性越强,不能根据氢化物的酸性判断元素的非金属性,故A错误;
B.原电池反应是自发的氧化还原反应,不需要外接电源,故B错误;
C.溶液上层呈橙红色,可知氯气氧化碘离子,由氧化还原反应中还原剂的还原性大于还原产物的还原性可知,I-还原性强于Cl-,故C正确;
D.Na在Cl2中燃烧的生成氯化钠,氯化钠中含离子键,但是,NaCl固体中的钠离子和氯离子不能自由移动,不能导电,故D错误.
故选C.
点评 本题考查较为综合,为高频考点,把非金属性的判断、原电池原理、化学键、现象与结论的关系、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
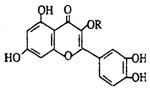
| A. | 可溶于有机溶剂 | B. | 分子中有三个苯环 | ||
| C. | 1mol维生素P可以和6molBr2反应 | D. | 1mol维生素P可以和4molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
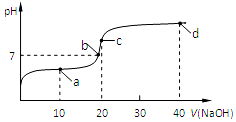 室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )| A. | a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | b点时:c(Na+)=c(CH3COO-) | |
| C. | c点时:c(OH-)=c(CH3COOH)+c(H+) | |
| D. | d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
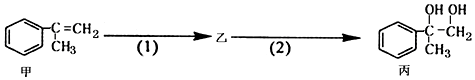
| A. | 物质丙能与氢氧化钠溶液反应 | |
| B. | 甲和丙均可使酸性KMnO4溶液褪色 | |
| C. | 反应(2)属于取代反应 | |
| D. | 步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
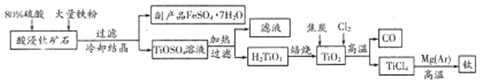
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
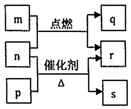 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:X<Y<Z | |
| B. | 非金属性:X>Y>Z | |
| C. | W、X、Y、Z四种元素可形成离子化合物 | |
| D. | q与s均为酸性氧化物,m的水溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com