
实验室中利用复分解反应制取Mg(OH)2。实验数据和现象如下表所示(溶液体积均取用1mL)
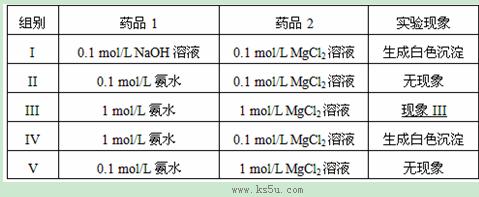
关于以上实验的说法正确是:( )
A. 实验Ⅱ、Ⅴ无现象,而Ⅳ生成白色沉淀,说明增大c(Mg2+)不能向生成沉淀的方向移动,增大氨水溶液的浓度才能向生成沉淀的方向移动。
B. 实验Ⅲ无现象,因为氯化镁溶液和氨水浓度都增大,则导致氯化铵浓度增大,而氢氧化镁可以溶解在氯化铵溶液中。
C. 由于氢氧化镁可以溶解在氯化铵溶液中,而氯化镁溶液和氨水反应可以生成氯化铵,所以该两种溶液混合后可能会出现先生成沉淀后溶解的现象。
D. 实验Ⅲ的现象是生成白色沉淀,因为增大两种溶液中任意一种的浓度,都能使混合液的离子积达到氢氧化镁的Ksp。
科目:高中化学 来源:模拟题 题型:实验题
Fe(OH)2是铁的一种氢氧化物,难溶于水,具有还原性,其制备方法较为特殊。下面是实验室制备
Fe(OH)2的方法之一:
(1)制备原理:利用复分解反应,使可溶性的亚铁盐溶液与可溶性的碱液反应生成Fe(OH)2。写出该反应的离子方程式_________________。
(2)NaOH溶液的制备:在试管中加入2~3 mL蒸馏水,加热至沸腾,冷却至室温,加入1片NaOH固体。制备NaOH溶液的蒸馏水加热的目的是___________。
(3)FeSO4溶液的制备:在试管中加入5 mL蒸馏水,并加热,直至蒸馏水沸腾,然后向蒸馏水中滴入几滴稀硫酸;待蒸馏水冷却至室温,加入少量FeSO4晶体,为了防止溶液中的Fe2+被氧化,在溶液中加入少量
____________。加入FeSO4晶体前在蒸馏水中加入稀硫酸的目的是____________。
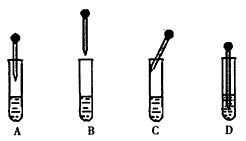
(4) Fe(OH)2的制备:下图中的胶头滴管中盛有NaOH溶液,试管中是FeSO4溶液。制备Fe(OH)2时正确的操作是___________(填字母序号),操作过程中________(填“能”或“不能”)振荡试管,原因是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com