
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
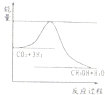
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
A.分馏 B.盐析 C.过滤 D.重结晶 E.升华 F.渗析G.电解 H.加热分解 I.蒸馏
下列各组混合物的分离或提纯应选用上述哪一种方法最合适?
(1)除去Ca(OH)2溶液中悬浮的CaCO3微粒,用__________。
(2)除去Fe(OH)3胶体中混有的Cl-离子,用__________。
(3)除去乙醇中溶解的微量食盐,用__________。
(4)分离石油中各种不同沸点范围的成分,用__________。
(5)除去固体碘中混有的少量NaI,用______________。
(6)除去氧化钙中的CaCO3,用________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A.分馏 B.盐析 C.过滤 D.重结晶
E.升华 F.渗析 G.电解 H.加热分解
I.蒸馏
下列各组混合物的分离或提纯应选用哪一种方法最合适?
(1)除去Ca(OH)2溶液中悬浮的CaCO3微粒,用___________。
(2)除去Fe(OH)3胶体中混有的Cl-离子,用___________。
(3)除去乙醇中溶解的微量食盐,用___________。
(4)分离石油中各种不同沸点范围的成分,用___________。
(5)除去固体碘中混有的少量NaI,用___________。
(6)除去氧化钙中的CaCO3___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com