
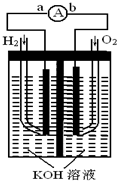
 (2009?天津)氢氧燃料电池是符合绿色化学理念的新型发电装置.
(2009?天津)氢氧燃料电池是符合绿色化学理念的新型发电装置.
| ||
| m |
| ρ |
| 20×7.9g |
| 0.8×103g/L |
| V(LiH) |
| V(H2) |
| 197.5×10-3L |
| 224L |


科目:高中化学 来源: 题型:阅读理解



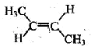
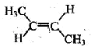


查看答案和解析>>
科目:高中化学 来源: 题型:
(2009天津六校二次联考,6)下列有关铁元素的叙述中正确的是( )
A.氢氧化铁可以由相关物质通过化合反应而制得
B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI====FeI3+3H2O
D.铁元素位于周期表的第四周期第ⅧB族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com