
 铁及其化合物在工农业生产、科学研究等方面具有广泛用途.回答下列问题:
铁及其化合物在工农业生产、科学研究等方面具有广泛用途.回答下列问题:| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | x | Y |
分析 (1)三价铁离子与碳酸根离子发生双水解生成氢氧化铁沉淀和二氧化碳;
(2)首先写出FeO(s)被CO还原成Fe和CO2的热化学方程式CO(g)+FeO(s)=Fe(g)+CO2(g)△H,利用盖斯定律①×3-(③×2+②)可得到该化学方程式,以此计算△H;
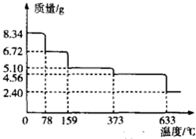
(3)温度为l59℃时,固体质量为5.10g,其中m(FeSO4)=0.03mol×152g/mol=4.56g,m(H2O)=5.10g-4.56g=0.54g,n(H2O)=$\frac{0.54g}{18g/mol}$=0.03mol,则n(H2O):n(FeSO4)=0.03mol:0.03mol=1:1,据此书写化学式;
633度是硫酸亚铁的分解,分解的固体物质为铁的氧化物,有图象可知此时固体质量为2.40g,其中n(Fe)=n(FeSO4•7H2O)=0.03mol,m(Fe)
=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,故n(O)=$\frac{0.72g}{16g/mol}$=0.045mol,则:n(Fe):n(O)=0.03mol:0.045mol=2:3,因此该温度分解的固体物质为Fe2O3,分解后的两种气体物质密度之比为4:5,故分别为SO2、SO3,依据原子个数,得失电子数守恒书写方程式;
(4)①化学平衡常数为生成物浓度幂之积与反应物浓度幂之积比值;平衡常数与温度有关,Fe(S)+CO2(g)?FeO(s)+CO(g)△H>0反应为吸热反应,所以升高温度,平衡常数增大,据此判断;
②500℃时,K=1,即K=$\frac{C(CO)}{C(C{O}_{2})}$=1,则平衡时C(CO)=C(CO2),据此计算平衡时C(CO2)及二氧化碳物质的量浓度变化量,依据速率计算公式解答;
③依据浓度、温度、压强对速率、化学平衡移动的影响判断解答;
(5)电解池中阳极发生氧化反应,依据方程式可知:铁在碱性环境下失去电子生成高铁酸根离子和水.
解答 解:(1)三价铁离子与碳酸根离子发生双水解生成氢氧化铁沉淀和二氧化碳,离子方程式:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
故答案为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
(2)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=-24.8kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47.2kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+640.5kJ•mol;
依据盖斯定律$\frac{①×3-(③×2+②)}{6}$得:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
(3)温度为l59℃时,固体质量为5.10g,其中m(FeSO4)=0.03mol×152g/mol=4.56g,m(H2O)=5.10g-4.56g=0.54g,n(H2O)=$\frac{0.54g}{18g/mol}$=0.03mol,则n(H2O):n(FeSO4)=0.03mol:0.03mol=1:1,所以化学式为FeSO4•H2O;
633度是硫酸亚铁的分解,分解的固体物质为铁的氧化物,有图象可知此时固体质量为2.40g,其中n(Fe)=n(FeSO4•7H2O)=0.03mol,m(Fe)
=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,故n(O)=$\frac{0.72g}{16g/mol}$=0.045mol,则:n(Fe):n(O)=0.03mol:0.045mol=2:3,因此该温度分解的固体物质为Fe2O3,分解后的两种气体物质密度之比为4:5,故分别为SO2、SO3,依据原子个数,得失电子数守恒反应的化学方程式:2FeSO4$\frac{\underline{\;633℃\;}}{\;}$Fe2O3+SO2↑+SO3↑;
故答案为:FeSO4•H2O;2FeSO4$\frac{\underline{\;633℃\;}}{\;}$Fe2O3+SO2↑+SO3↑;
(4)①Fe(S)+CO2(g)?FeO(s)+CO(g)△H>0平衡常数为:K=$\frac{C(CO)}{C(C{O}_{2})}$;反应为吸热反应,所以升高温度,平衡常数增大,故xy呈增大趋势,且x大于1,只有a项符合要求,故a项正确;
故答案为:$\frac{C(CO)}{C(C{O}_{2})}$;a;
②500℃时,K=1,即K=$\frac{C(CO)}{C(C{O}_{2})}$=1,则平衡时C(CO)=C(CO2),则△C(CO2)=$\frac{2mol-1mol}{2L×10min}$=0.05mol/(L•min);
故答案为:0.05mol/(L•min);
③800℃时,在反应达到平衡状态后,要使反应速率减小且平衡逆向移动,则需要降低反应物浓度,二氧化碳为反应物,所以可以减小二氧化碳的物质的量;
该反应为吸热反应,降低温度,反应速率降低,平衡逆向移动;
故答案为:减小二氧化碳的物质的量(或者降低温度);
(5)电解池中阳极发生氧化反应,依据方程式可知:铁在碱性环境下失去电子生成高铁酸根离子和水,电极反应式为:Fe+8OH--6e-=FeO42-+4H2O;
故答案为:Fe+8OH--6e-=FeO42-+4H2O;
点评 本题为综合题,考查了盐类水解方程式的书写,热化学方程式的书写,化学平衡表达式的书写及平衡常数的应用,反应速率、化学平衡移动的影响因素,电解池电极反应式的书写,题目综合性较强,熟练掌握盖斯定律计算反应热方法,明确化学平衡的相关理论,电解池工作原理是解题关键,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| C. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| D. | 金属氧化物一定不能与碱发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应物A的转化率 | B. | 平衡混合气中物质B的质量分数 | ||
| C. | 平衡混合气的密度 | D. | 平衡混合气中C的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容器 | 1 | 2 | 3 | 4 |
| 反应物投入量 (始态) | 1mol CO2 3mol H2 | 1mol CH3OH 1mol H2O | 2mol CH3OH 2mol H2O | 0.8mol CO2 2.4mol H2 0.2mol CH3OH 0.2mol H2O |
| CH3OH的平衡浓度/mol•L-1 | c1 | c2 | c3 | c4 |
| 反应的能量变化 | 放出 x kJ | 吸收y kJ | 吸收z kJ | 放出 w kJ |
| 体系压强/Pa | p1 | p2 | p3 | p4 |
| 反应物转化率 | a1 | a2 | a3 | a4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
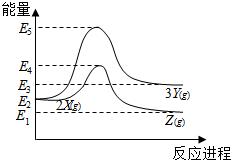
| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H>0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
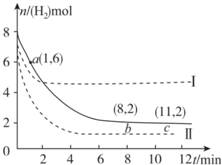
| A. | 若曲线I对应的条件改变是升高温度,则该反应△H>0 | |
| B. | 曲线II对应的条件改变是降低压强 | |
| C. | 反应开始至a点时v(H2)=1mol•L-1•min-1 | |
| D. | 保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2 mol•L-1<c(CH3OH)<$\frac{8}{3}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g重水(D2O)所含的中子数为10NA | |
| B. | 100℃时,1LpH=1的硫酸溶液中,含有0.2NA个H+ | |
| C. | 71g氯气发生氧化还原反应,一定失去2NA个电子 | |
| D. | 室温下,14gN2和CO的混合气体中含有的原子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com