
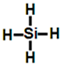 .
. 分析 单质Z是一种带有金属光泽的灰黑色固体,可由其氧化物X经三步反应制取,Z为Si,X为SiO2,SiO2先与C反应生成Si,Si与氯气反应生成四氯化硅,四氯化硅再与氢气反应生成Si,X和镁条在加热条件下生成两种原子个数比分别为1:1和1:2的化合物A和B,A为MgO,B为Mg2Si,发生SiO2+4Mg$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+Mg2Si,B和盐酸反应生成Z的氢化物Y,Y为SiH4,再加热分解Y制得Z,以此解答该题.
解答 解:单质Z是一种带有金属光泽的灰黑色固体,可由其氧化物X经三步反应制取,Z为Si,X为SiO2,SiO2先与C反应生成Si,Si与氯气反应生成四氯化硅,四氯化硅再与氢气反应生成Si,X和镁条在加热条件下生成两种原子个数比分别为1:1和1:2的化合物A和B,A为MgO,B为Mg2Si,发生SiO2+4Mg$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+Mg2Si,B和盐酸反应生成Z的氢化物Y,Y为SiH4,再加热分解Y制得Z,
(1)硅具有导电性,可用于半导体材料、电脑芯片、太阳能电池板等,故答案为:半导体材料、电脑芯片、太阳能电池板等任答一种;
(2)二氧化硅与镁在加热条件下反应,方程式为SiO2+4Mg$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+Mg2Si,故答案为:SiO2+4Mg$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+Mg2Si;
(3)由B生成Y的化学反应方程式为Mg2Si+4HCl=2MgCl2+SiH4↑,SiH4的结构式为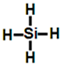 ,故答案为:Mg2Si+4HCl=2MgCl2+SiH4↑;
,故答案为:Mg2Si+4HCl=2MgCl2+SiH4↑;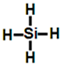 .
.
点评 本题主要考查的是元素的推断以及硅和其化合物的知识,为高频考点,侧重于学生的分析能力的考查,涉及化学反应方程式书写、结构式等知识,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 请回答下列问题:
请回答下列问题: (4)请写出HClO的电子式:
(4)请写出HClO的电子式: .
.| 电离能/KJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油中 | |
| B. | 浓硝酸盛放在无色瓶中 | |
| C. | 少量白磷保存在冷水中 | |
| D. | 氢氧化钠溶液盛放在橡胶塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子间以单键相连的链烃是烷烃 | B. | 所有糖类物质都有甜味 | ||
| C. | 糖类、油脂都能发生水解 | D. | 淀粉与纤维素互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 g 46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| B. | 标准状况下,2.24 L氯气溶于水发生反应,转移的电子数目为0.1NA | |
| C. | 高温下,0.2 mol的铁与足量的水蒸气反应,生成氢气的分子数目为0.3NA | |
| D. | 25℃时,100 mL pH=13的Ba(OH)2溶液中OH-的数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
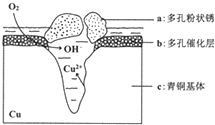 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b-a=n+m | B. | 离子半径Ym-<Xn+ | C. | 原子序数Y>X | D. | 离子半径Xn+<Ym- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu、Si、Zn、Au | B. | Ag、C、Al、Pb | C. | Fe、C、Mg、Pt | D. | Cu、S、Fe、Pt |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com