
【题目】以下转化能通过一步反应实现的是
A.CuO→Cu(OH)2 B.S →SO3 C.Fe→FeCl2 D.HNO3→HCl
科目:高中化学 来源: 题型:
【题目】下列能量转化过程与氧化还原反应无关的是
A.硅太阳能电池工作时,光能转化成电能
B.锂离子电池放电时,化学能转化成电能
C.电解质溶液导电时,电能转化成化学能
D.葡萄糖为人类生命活动提供能量时,化学能转化成热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】置换反应是中学化学中常见的反应类型,其的通式可表示为:
单质甲+化合物A=单质乙+化合物B
单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若单质乙为空气中的一种主要成分,则该反应的化学方程式为 。
(2)若单质甲和化合物B均具有铁磁性,则该反应的化学方程式为 。
(3)若化合物A是红棕色粉末状固体,化合物B具有两性,则该反应的化学方程式为 。
(4)若单质乙是做光伏电池组件的重要材料,写出该反应的化学方程式 。
(5)若单质甲是金属,化合物A为一种温室效应气体,则该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
A.物质的量浓度为0.5 mol·L-1 (NH4)2SO4溶液中,含有NH4+个数小于NA
B.1mol羟基中电子数为10NA
C.3.9gNa2O2晶体中阴阳离子总数为0.2NA
D.含4molHCl的浓盐酸和足量MnO2加热反应可生成Cl2分子少于NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F六种元素中,除F外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 其形成的一种同位素原子在考古中可推测化石的年代 |
B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
C | 地壳中含量最多的元素 |
D | D原子的内层电子数是最外层电子数的5倍 |
E | 其单质主要存在于火山口附近 |
F | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
请回答下列问题:
(1)A在元素周期表中的位置是_______________;A与C形成的化合物AC2的电子式是__________。
(2) 下列事实能证明C和E的非金属性强弱的是 。(填序号)
①常温下,C的单质呈气态,E的单质呈固态
②C的气态氢化物的稳定性强于E的气态氢化物的稳定性
③C与E形成的化合物中,E呈正价
④E的氢化物的沸点高于C的氢化物的沸点
(3) 由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是 (填化学式),它与足量NaOH溶液在加热时反应的离子方程为: 。
(4) FC与足量B的最高价氧化物的水化物的稀溶液反应的离子方程式 。若有标准状况下5.6L的BC生成,则转移的电子数为 。
(5) A的氢化物有多种,1 mol A的某种氢化物分子中含有14 mol电子,已知在25℃、101kPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40 kJ,写出表示该氢化物燃烧热的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa下,4g CH4完全燃烧生成CO2和液态H2O时,放出222.5 kJ的热量,则下列热化学方程式中正确的是 ( )
A.CH4(g)+2O2(g)=CO2(g)+4H2O(g) ΔH=-890 kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890 kJ/mol
C.![]() CH4(g)+O2(g)=
CH4(g)+O2(g)=![]() CO2(g)+H2O(l) ΔH=-445 kJ/mol
CO2(g)+H2O(l) ΔH=-445 kJ/mol
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3的比较中,下列说法不正确的是( )
A.NaHCO3固体受热容易分解,而Na2CO3固体受热不容易分解
B.等质量的Na2CO3和NaHCO3分别与足量同浓度的盐酸反应,前者消耗盐酸的量比后者多
C.等物质的量浓度的Na2CO3和NaHCO3溶液中分别滴加2滴酚酞溶液,前者颜色比后者深
D.Na2CO3溶液和NaHCO3溶液分别与Ba(OH)2溶液反应的离子方程式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2![]() N2O4
N2O4![]() )
)
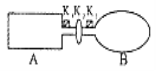
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A)________(填“>”、“<”、“=”)v(B);若打开活塞K2,气球B将________(填“增大”、“减小”、“不变”)。
(2)若平衡后在A、B中再充入与初始量相等的NO2,则达到平衡时,A中的NO2转化率________,B中的NO2转化率将________(填“增大”、“减小”、“不变”);若通入等量的Ne气,则达到平衡时,A中的NO2转化率________,B中的NO2转化率将________(填“增大”、“减小”、“不变”)。
(3)室温下,若A、B都保持体积不变,将A套上—个绝热层,B与外界可以进行热传递,则达到平衡时,____________中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时的N2O4物质的量为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com