
【题目】在常温常压下,24mLH2S和O2的混合气体点燃后,生成6mLSO2,则原混合气体中H2S的体积可能为
A. 10mLB. 12mLC. 16mLD. 18mL
【答案】B
【解析】
依据阿伏加德罗推论可知:恒温恒压下,![]() =
=![]() ;H2S和O2反应时有两种情况即当氧气过量时发生2H2S+3O2
;H2S和O2反应时有两种情况即当氧气过量时发生2H2S+3O2![]() 2H2O+2SO2、当氧气少量时会发生2H2S+O2
2H2O+2SO2、当氧气少量时会发生2H2S+O2![]() 2H2O+2S↓。据此解题。
2H2O+2S↓。据此解题。
设原混合气体中H2S的体积为x mL,则:
2H2S+3O2![]() 2H2O+2SO2
2H2O+2SO2
2Vm 3Vm 2Vm 2Vm
x y 6mL
计算可得
x=6mL y=9mL
所以反应生成SO2的H2S为 6mL。
当氧气过量时,气体总体积为24mL,所以H2S为6mL,O2为18mL;
当H2S过量时,H2S与O2反应的产物有SO2和S,其中生成SO2的H2S为 6mL,O2为9mL,生成S的H2S与O2总量为 24-6-9=9mL,涉及到的反应为:
2H2S+O2![]() 2H2O+2S↓,其中由于
2H2O+2S↓,其中由于![]() =
=![]() ,则
,则![]() =
=![]() =
=![]() 。因此H2S总体积为6+6=12mL,O2为9+3=12mL。
。因此H2S总体积为6+6=12mL,O2为9+3=12mL。
答案选B。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
A. ![]() 、
、![]() 、
、![]() 中,所有原子都满足最外层8电子的稳定结构
中,所有原子都满足最外层8电子的稳定结构
B. 在元素周期表中金属和非金属交界处可以找到半导体材料
C. 由非金属元素组成的化合物一定是共价化合物
D. 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
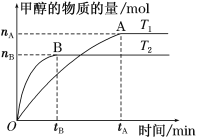
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)如图是元素周期表的一部分,回答下列问题: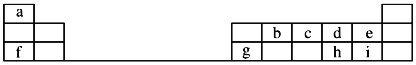
![]() 元素e的负一价离子的结构示意图为 ______ ,f、g、h、i对应简单离子的半径由大到小的顺序为 ______
元素e的负一价离子的结构示意图为 ______ ,f、g、h、i对应简单离子的半径由大到小的顺序为 ______ ![]() 用具体微粒符号表示
用具体微粒符号表示![]() .
.
![]() 元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为 ______ .
元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为 ______ .
![]() 、c、d三种原子的第一电离能大小顺为 ______
、c、d三种原子的第一电离能大小顺为 ______ ![]() 用具体微粒符号表示
用具体微粒符号表示![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.难溶于水的化合物是非电解质
B.某化合物的水溶液可以导电,所以该化合物是电解质
C.硫酸是电解质,所以硫酸在熔化和溶于水时都能导电
D.液态氯化氢不能导电,但氯化氢是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关焰色反应的实验操作及注意事项正确的是( )
A.只有把盐配制成溶液才能进行焰色反应
B.实验时用铂丝直接蘸取药品在酒精灯上灼烧
C.可以用铁丝代替铂丝进行焰色反应
D.实验后要用稀硫酸将铂丝洗净
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a、b、c、d四种短周期主族元素,在周期表中相对位置如图,下列说法正确的是
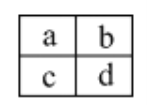
A. a、c两元素的最高正价一定相等
B. 原子半径大小顺序为:c>d>b>a
C. a、b两元素可能形成多种共价化合物
D. c、d二种元素气态氢化物的稳定性比较:c > d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案(已知:AlN+NaOH+H2O===NaAlO2+NH3↑)。
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
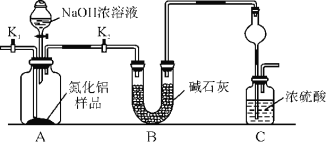
(1)上图C装置中球形干燥管的作用是_________。
(2)完成以下实验步骤:组装好实验装置,首先检查气密性,再加入实验药品,接下来的实验操作是______________________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见:_________________________。
(方案2)用下图装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
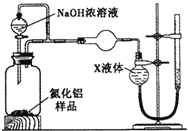
(4)为测定生成气体的体积,量气装置中的X液体可以是__________。
A.CCl4 B.H2O C.NH4Cl溶液 D.苯
(方案3)按以下步骤测定样品中AlN的纯度:
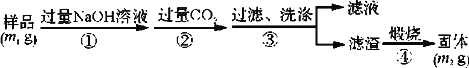
(5)步骤②生成沉淀的离子方程式为__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com