


科目:高中化学 来源: 题型:
| A、无色溶液中:K+、Na+、Cu2+、SO42- |
| B、水电离产生的c(H+)=10-13mol?L-1的溶液中:Na+、Cl-、NO3-、SO42- |
| C、0.1mol?L-1 FeSO4溶液中:K+、NH4+、MnO4-、ClO- |
| D、c(OH-)=10-13mol?L-1的溶液中:Al3+、NO3-、I-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
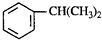 ) ⑧乙炔.按下列要求填空:
) ⑧乙炔.按下列要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置,实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意效果.
实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置,实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意效果.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 某些石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
某些石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com