
【题目】有关做焰色反应实验时的注意事项,下列说法不正确的是( )
A. 每次实验中都要先将铂丝灼烧到火焰无色,再蘸取被检验物质
B. 钾的焰色反应要透过蓝色钴玻璃观察
C. 实验时最好选择本身颜色较深的火焰
D. 没有铂丝可用光洁无锈铁丝代替进行实验
科目:高中化学 来源: 题型:
【题目】我国药学家屠呦呦因发现植物黄花蒿叶中含有抗疟疾的物质﹣青蒿素而荣获2015年诺贝尔奖.科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚.下列说法不正确的是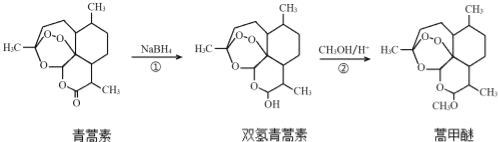
A. 利用黄花蒿叶研究青蒿素结构的基本步骤为:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式
B. 双氢青蒿素在水中的溶解性大于青蒿素
C. ①、②的反应类型分别为还原反应、取代反应
D. 青蒿素转化为双氢青蒿素,手性碳个数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:I1=578KJmol﹣1 I2=1817KJmol﹣1 I3=2745KJmol﹣1I4=11575KJmol﹣1 I5=14830KJmol﹣1 I6=18376KJmol﹣1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为;X、Y、Z三种元素原子的第一电离能由小到大的顺序为(用元素符号表示).
(2)W的氯化物的熔点比Q的氯化物的熔点(填“高”或“低”),理由是
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]﹣生成,则[W(OH)4]﹣中存在(填字母) . a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如图所示.则该晶体的化学式为;晶体中每个镁原子周围距离最近的R原子有个.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液存在水解平衡:S2+H2O![]() HS+OH。下列说法正确的是( )
HS+OH。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大
B. 升高温度,c(HS)/c(S2)增大
C. 加入NaOH固体,溶液pH减小
D. 通入CuSO4固体,HS浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫酸分解磷尾矿[主要成份为Ca5(PO4)3F]可制得中强酸磷酸H3PO4。请回答:
(1)Na2HPO4溶液呈碱性,则在该溶液中c(H2PO4-)_____c(PO43-)(填“>”、“<”、“=”),向Na2HPO4溶液中加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从电离平衡移动角度分析):________________________。
(2)Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
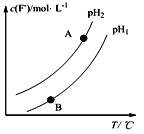
则:适当______温度有利于磷尾矿转化为羟基磷灰石(填“升高”、“降低”);pH1___pH2(填“>”、“<”、“=”);A、B两点的溶液中F—的速率v(A)____v(B)(填“>”、 “<”、“=”);
(3)已知:25℃时,H3PO4的电离平衡常数:K1=7.52×10-3;K2=6.23×10-8;K3=6.23×10-13,则:H3PO4(aq)+OH-(aq)![]() H2PO4-(aq)+H2O (l)的平衡常数K=____________。
H2PO4-(aq)+H2O (l)的平衡常数K=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,对于可逆反应A(?)+3B(?)![]() 2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )
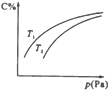
A. 若正反应方向ΔH<0,则T1>T2
B. A一定为气体
C. B一定为气体
D. 压强增大时,混合气体的平均相对分子质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于油脂的叙述中,错误的是( )
A.从溴水中提取溴可用植物油作萃取剂
B.用热的烧碱溶液可以区别植物油和矿物油
C.生产盐酸和人造脂肪都必须用氢气做原料
D.硬水使肥皂的去污能力减弱,是因为发生了沉淀反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修2:化学与技术】
(1)火山喷发所产生的硫磺可用于生产重要的化工原料硫酸.某企业用右图所示的工艺流程生产硫酸:请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装(填设备名称).吸收塔中填充有许多瓷管,其作用是 .
②为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%.为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 . 假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 . (空气中氧气的体积分数按0.2计),该尾气的处理方法是 .
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是(可多选).
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面(可多选).
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下纯水中c(H+)=2×10﹣7 molL﹣1,则此时c(OH﹣)=_____;该温度下向纯水中滴加盐酸使c(H+)=5×10﹣6 molL﹣1,则此时c(OH﹣)=_____.
(2)某温度下重水(D2O)的离子积常数为1.6×10﹣15,像定义pH一样来规定pD=﹣lgc(D+),请回答以下问题:
①写出重水的电离方程式:_____.
②该温度下,重水中的c(D+)=_____,pD=_____.(已知lg 2=0.3)
③0.01molL﹣1的NaOD溶液中pD=_____.
(3)若要将100mL水的pH值由7变为如下数值(体积变化不计),填写下列各空:
①加入金属钠_____g后溶液的pH=14;
②当加入三氧化硫___g后溶液的pH值与加入0.1molHClO4时相同,此时pH=___.
③加入0.1molL﹣1的盐酸_____mL后溶液pH=4.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com