
| 选项 | 用途 | 解释 |
| A | 硅胶可作袋装食品的干燥剂 | 硅胶多孔,吸收空气中氧气的能力强 |
| B | CuSO4可作游泳池的消毒剂 | 铜盐能使构成病毒的蛋白质变性 |
| C | 浸有高锰酸钾溶液的硅藻土可作某些水果的保鲜剂 | 高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| D | Na2O2可作呼吸面具中的供氧剂 | Na2O2能吸收CO2同时放出O2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硅胶多孔,具有吸附性,可用于吸水;
B.硫酸铜为重金属盐,可使蛋白质变性;
C.乙烯具有还原性,可被酸性高锰酸钾氧化;
D.过氧化钠与二氧化碳反应生成氧气.
解答 解:A.硅胶多孔,具有吸附性,可用于吸水,以此用作干燥剂,故A错误;
B.硫酸铜为重金属盐,可使蛋白质变性,可用于杀菌消毒,故B正确;
C.乙烯为水果的催熟剂,具有还原性,可被酸性高锰酸钾氧化,有高锰酸钾溶液的硅藻土可起到保鲜的作用,故C正确;
D.过氧化钠与二氧化碳反应生成氧气,可用作供氧剂,故D正确.
故选A.
点评 本题多角度考查物质的性质及应用,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:解答题

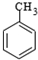 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$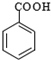
 .
.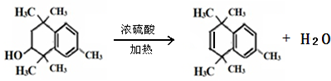 .
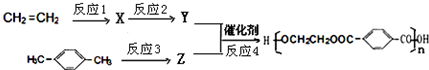
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
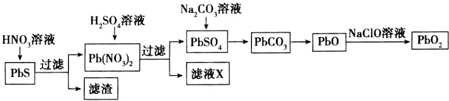
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 投料比[n(NO2)/n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
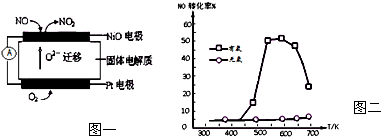
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
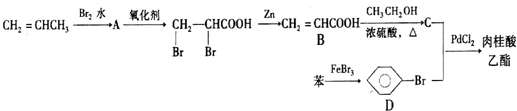
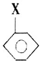 +CH2═CHCOOCH3$\stackrel{PdCl_{2}}{→}$
+CH2═CHCOOCH3$\stackrel{PdCl_{2}}{→}$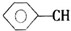 =CHCOOCH3+HX(X为卤素原子)
=CHCOOCH3+HX(X为卤素原子)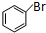 +CH2=CHCOOCH2CH3$\stackrel{PdCl_{2}}{→}$
+CH2=CHCOOCH2CH3$\stackrel{PdCl_{2}}{→}$ +HBr.
+HBr.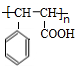 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用原煤脱硫技术,可减少燃煤时产生的SO2 | |
| B. | 食品中适量添加防腐剂,可以保障安全 | |
| C. | 垃圾分为可回收物、厨余垃圾、有害垃圾、其它垃圾等,废旧电池属于可回收垃圾 | |
| D. | 用红薯酿酒的过程中包含氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:填空题
填写下列空白:
(1)标准状况下,1.1 g某气态氧化物RO2的体积为0.56 L。该气体的摩尔质量是 。
(2)标准状况下,密度为1.25 g·L-1的CO2与CH4组成的混合气体中,CO2的体积分数为 ,该混合气体对氢气的相对密度为 。
(3)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该化合物加热至结晶水全部失去,剩余的残渣为b g,则n= 。
(4)将标准状况下体积为a L的HCl气体溶于1000g水中,得到盐酸的密度为b g/cm3,则该盐酸的物质的量浓度为 mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com