
| A. | 13g 和 和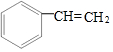 的混合物中含有的电子数为7NA 的混合物中含有的电子数为7NA | |
| B. | 60gSiO2中含有的共价键数目为4NA | |
| C. | 标准状况下,11.2LH2和Cl2反应后得到的气体中含有的原子总数为NA | |
| D. | 1molNaCO3溶于水后,所得溶液中CO32-和HCO3-的总数为NA |
分析 A.苯与苯乙烯具有相同最简式CH,1个CH含有7个电子,依据质量计算混合物含有CH物质的量和所含电子数目;
B.质量换算物质的量结合1mol二氧化硅中含4mol硅氧键;
C.氢气与氯气都是双原子分子,结合原子个数守恒解答;
D.碳酸根离子水解生成碳酸氢根离子,碳酸氢根离子水解生成碳酸,依据碳原子个数守恒解答.
解答 解:A.13g 和
和 的混合物含有CH原子团物质的量为$\frac{13g}{13g/mol}$=1mol,含有电子数为1mol×7×NA=NA,故A正确;
的混合物含有CH原子团物质的量为$\frac{13g}{13g/mol}$=1mol,含有电子数为1mol×7×NA=NA,故A正确;
B.1mol二氧化硅中含4mol硅氧键,60gSiO2物质的量为$\frac{60g}{60g/mol}$=1mol,含有的共价键数目为4NA,故B正确;
C.标准状况下,11.2LH2和Cl2物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,二者都是双原子分子,依据原子个数守恒,反应后含有原子物质的量为0.5mol×2=1mol,个数NA,故C正确;
D.1molNaCO3溶于水后,碳酸根离子水解生成碳酸氢根离子,碳酸氢根离子水解生成碳酸,所得溶液中CO32-和HCO3-、H2CO3,总数为NA,故D错误;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,注意盐类水解规律及物料守恒规律,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 物质 | 试剂 | 分离方法 | |
| ① | 乙烷(乙烯) | H2 | 催化剂加热 |
| ② | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(苯酚) | 浓溴水 | 分液 |
| A. | ①② | B. | ①③ | C. | ③④ | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、OH- | B. | H+、Ca2+、CO32-、NO3- | ||
| C. | Na+、HCO3-、OH-、Ca2+ | D. | Cu2+、K+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将气体通过湿润的淀粉KI试纸,试纸变蓝,证明原气体是Cl2 | |
| B. | 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 将气体通过澄清石灰水,溶液变浑浊,证明原气体是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol环丙烷中含有共价键的数目为NA | |
| B. | 0.1molCl2全部溶于水后转移电子的数目为0.1NA | |
| C. | 2.24LSO3中含有氧原子的数目为0.3NA | |
| D. | 9.2g由乙醇和二甲醚(CH3OCH3)组成的混合物中含有氧原子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
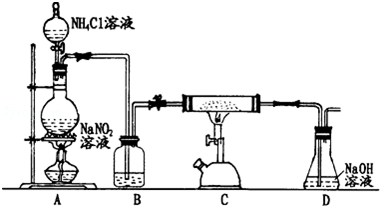
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
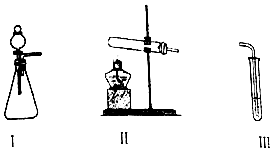
| 操作 | 现象 | |
| 甲 | 向I中加入必要的试剂,并向III中加入KI、淀粉溶液.连接I、III,打开活塞 | I中剧烈反应,产生无色气体并伴随大量白雾;III中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向II中加入必要的试剂,并向III中加入KI、淀粉溶液和稀硫酸.连接II、III,点燃酒精灯 | III中有气泡冒出,溶液变蓝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com