
(8分)某浅绿色溶液A中加入用硝酸酸化的硝酸银酸性溶液,生成白色沉淀B和黄色溶液C,再向溶液C中加入足量的氨水生成红褐色沉淀D。
根据以上判断:
(1)A、B、C、D的化学式:A B C D
(2)写出C到D反应的离子方程式
(3)写出A和硝酸反应的化学方程式
(1)A: FeCl2 B: AgCl C: FeCl3 D: Fe(OH)3\
(2)Fe3++3NH3.H2O= Fe(OH)3↓+3NH4+
(3)3FeCl2 + 4HNO3 ="=" 2FeCl3 + Fe(NO3)3 + NO↑+ 2H2O
解析试题分析:浅绿色溶液A,说明A中含有Fe2+,加入用硝酸酸化的硝酸银酸性溶液,生成白色沉淀B和黄色溶液C,则B是AgCl,黄色溶液是Fe2+被氧化成Fe3+,说明A中含有Cl-,所以A是FeCl2,C是FeCl3。向C溶液加入足量的氨水生成红褐色沉淀D,则D是Fe(OH)3。
考点:无机推断
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合.它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法.。解框图题的方法:最关键的是寻找"突破口"!,"突破口"就是抓"特"字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:阅读理解

| ||

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

A中放有
试回答下列问题:
(1)请写出在蒸发皿中制得莫尔盐的化学方程式:_________________________________。
(2)滴加稀硫酸时,发现其反应速率比同浓度硫酸与纯铁粉反应快,其原因是___________
_____________________________________。
(3)取
①配平下列反应式:
______Fe2++______![]() +______H+——______Mn2++______Fe3++______H2O
+______H+——______Mn2++______Fe3++______H2O
②用________(酸式或碱式)滴定管盛装高锰酸钾溶液。
③高锰酸钾溶液的物质的量浓度是________。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省苏中三市高三5月第二次调研测试化学试卷(带解析) 题型:实验题
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
⑴孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L—1的Cu(NO3)2溶液、2.0mL 0.50 mol·L—1的NaOH溶液和0.25 mol·L—1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
| 编号 | V (Na2CO3)/ mL | 沉淀情况 | | 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 | | 1 | 40 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 | | 2 | 60 | 少、浅绿色 |
| 3 | 2.0 | 较多、绿色 | | 3 | 75 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 | | 4 | 80 | 较多、绿色(少量褐色) |
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高二上学期期中考试文科化学试卷(解析版) 题型:判断题
(8分)某浅绿色溶液A中加入用硝酸酸化的硝酸银酸性溶液,生成白色沉淀B和黄色溶液C,再向溶液C中加入足量的氨水生成红褐色沉淀D。
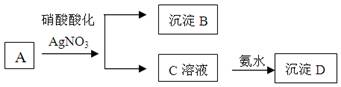
根据以上判断:
(1)A、B、C、D的化学式:A B C D
(2)写出C到D反应的离子方程式
(3)写出A和硝酸反应的化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com