
【题目】W、X、Y、Z是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。下列叙述不正确的是
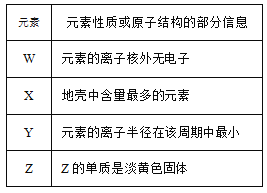
A. W与Z形成的化合物在常温下为气体
B. Y的最高价氧化物对应的水化物显强碱性
C. X和Z形成的常见化合物能形成酸
D. 简单氢化物的稳定性:X > Z
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0在一定条件下达到平衡状态,t1时刻改变条件,反应速率与时间关系如右图,下列说法正确的是
2SO3(g) ΔH<0在一定条件下达到平衡状态,t1时刻改变条件,反应速率与时间关系如右图,下列说法正确的是

A.维持温度不变,t1时扩大容积
B.维持压强不变,t1时升高温度
C.维持温度和压强不变,t1时充入SO3(g)
D.维持温度与容积不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境保护、工业生产、生活等密切相关,下列说法不正确的是( )
A. 在食品袋中放入装有硅胶、铁粉的透气小袋,可防止食物受潮、氧化变质
B. 因SO2具有氧化性,故可用于漂白纸浆
C. 刚玉、红宝石主要成分是氧化铝,陶瓷、分子筛主要成分是硅酸盐
D. 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物X和Y都是从樟脑科植物中提取的香料。X可按下列路线合成Y。

已知:

(1)X的官能团名称为__________________。
(2)Y的结构简式为_____________________。
(3)D+G→Y的有机反应类型为__________________。
(4)下列物质不能与D反应的是_________(选填序号)。
a.金属钠 b.氢溴酸 c.碳酸钠溶液 d.乙酸
(5)写出下列反应方程式:
X→G的第①步反应______________________。
E→F______________________。
(6)G有多种同分异构体,写出同时满足下列条件的G的所有同分异构体的结构简式______________________。
i.能发生银镜反应 ii.能发生水解反应 iii.苯环上只有一个取代基
(7)G的一种同分异构体H的结构简式为![]() ,写出以
,写出以![]() 为有机原料,制取H的合成路线(可任选无机原料)。
为有机原料,制取H的合成路线(可任选无机原料)。
![]()
![]() ______________________
______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2L的密闭容器中充入一定量的H2O和CO,维持700℃发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g),反应过程中测定的部分数据见下表(表中t1<t2):
CO2(g) + H2(g),反应过程中测定的部分数据见下表(表中t1<t2):
反应时间/min | n(CO)/mol | H2O/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 其他条件不变,起始时容器中充入0.60molCO和1.20 molH2O,达平衡时,n(CO2)=0.40 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D. 若温度升至800℃,上述反应的平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质应用的说法中错误的是
A. 硅胶作瓶装药品的干燥剂 B. 液氨用作医疗制冷剂
C. 小苏打作烘焙食品的膨松剂 D. 用石英坩埚熔融纯碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮的化合物广泛存在于自然界,是一类非常重要的化合物。回答下列问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。己知该反应的相关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=________kJ/mol.
(2)在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示。“高温下,该反应能逆向自发进行,原因是___________________________。
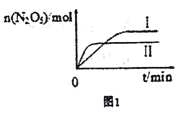
②下列有关该反应的说法正确的是________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则砌氢化钠燃料电池的负极反应式为___________。
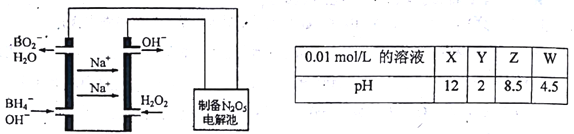
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。上表是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为________________。
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II:2NO(g)+Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
①4NO(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应II达到平衡。测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=_____;其他条件不变,反应II在恒压条件下进行,平衡时NO的转化率α2___α1 (填“>”“<”或span>“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一恒容容器中进行如下反应 N2+3H2![]() 2NH3,下列情况一定能说明反应 已达到平衡的是( )
2NH3,下列情况一定能说明反应 已达到平衡的是( )
①容器内压强不随时间而变化
②单位时间内,有 3molH2 反应,同时有 2molNH3 生成
③气体的密度不随时间而变化
④单位时间内,有 1molN2 生成,同时有 2molNH3 生成
⑤用 N2、 H2、NH3 表示的该反应的化学反应速率之比为 1∶3∶2
⑥气体的平均摩尔质量不随时间而变化
A.①④⑥ B.①②③ C. ②③⑤ D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2molL﹣1 NaOH的溶液450mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是( )
A.500mL,40g
B.500mL,36g
C.450mL,36g
D.450mL,40g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com