
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。

(1)物质A的化学式为___,F化学式为___;
(2)B和R在溶液中反应生成F的离子方程式为___;
(3)H在潮湿空气中变成M的实验现象是___,化学方程式为___。
(4)A和水反应生成B和C的离子方程式为___,由此反应可知A有作为___的用途。
(5)M投入盐酸中的离子方程式___。
【答案】Na2O2 H2 2Al+2OH-+2H2O=2AlO2-+3H2↑ 白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Na2O2+2H2O=4Na++4OH-+O2↑ 供氧剂 Fe(OH)3+3H+=Fe3++3H2O
【解析】
A为淡黄色固体,其能与水反应,则其为Na2O2;R是地壳中含量最多的金属元素的单质,则其为Al;T为生活中使用最广泛的金属单质,则其为Fe;D是具有磁性的黑色晶体,则其为Fe3O4;Na2O2与水反应生成NaOH和O2,所以C为O2;Al与NaOH溶液反应,生成偏铝酸钠和氢气,所以F为H2,B为NaOH;Fe3O4与盐酸反应,生成FeCl3、FeCl2和水,FeCl3再与Fe反应,又生成FeCl2,所以E为FeCl2;它与NaOH溶液反应,生成白色沉淀Fe(OH)2,它是H;Fe(OH)2在空气中被氧化为Fe(OH)3,它与盐酸反应生成FeCl3,它为W。
(1)物质A的化学式为Na2O2。答案为:Na2O2
F化学式为H2。答案为:H2
(2)NaOH和Al在溶液中反应生成H2的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)Fe(OH)2在潮湿空气中变成Fe(OH)3的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色。答案为:白色沉淀迅速变成灰绿色,最终变成红褐色
化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(4)Na2O2和水反应生成NaOH和O2的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。
答案为:2Na2O2+2H2O=4Na++4OH-+O2↑
由此反应可知A有作为供氧剂的用途。答案为:供氧剂
(5)Fe(OH)3投入盐酸中的离子方程式Fe(OH)3+3H+=Fe3++3H2O。
答案为:Fe(OH)3+3H+=Fe3++3H2O


科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到相应目的的是
A | B | C | D | |
目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述不正确的是
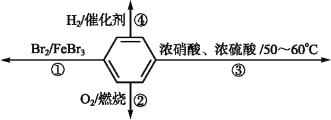
A.反应①为取代反应,有机产物与水混合时分层并处于下层
B.反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C.反应③为取代反应,可用水浴加热控制温度
D.反应④中1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金(含铁)空心球为吸收剂的太阳能吸热涂层,铁与镍基态原子未成对电子数之比为_____。
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯C60的分子模型如图所示,可用作储氢材料,已知金刚石中的C-C键的键长为0.154 nm,C60中C-C键键长为0.140~0.145 nm,富勒烯(C60)晶体与金刚石相比,____的熔点较高。分子中碳原子轨道的杂化类型为____;1 molC60分子中σ键的数目为____。科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为____。
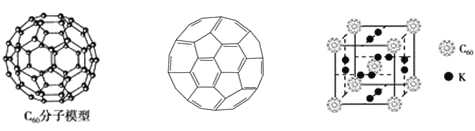
(3)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是_____。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为_____个。
(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As____Se(填“>”“<”或“=”)。
②二氧化硒分子的空间构型为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧法是确定有机物分子式常用的方法:在电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。若实验中所取样品A只含C、H、O三种元素中的两种或三种,准确称取0.92 g样品,经充分反应后,测得生成1.76 gCO2和1.08 g水;回答下列问题:
(1)样品A的实验式为____________。能否根据A的实验式确定A的分子式_______ (填“能”或“不能”),若能,则A的分子式是____________________ (若不能,则此空不填)。
(2)样品A不能与金属钠反应,则其结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)现有四种有机物:①乙烯,②2-丙醇,③甲苯,④![]() ,⑤
,⑤![]() ,⑥
,⑥ ,⑦
,⑦![]() ,⑧
,⑧![]() 其中:
其中:
(1)能衡量一个国家的石油化工生产水平的是__________(填序号),该物质可用于制备常用塑料,其反应化学方程式是_______________________。
(2)能用来制取梯恩梯(TNT)的是________(填序号),其发生反应的化学方程式是__________________;
(3)上述有机物能与金属钠发生反应的是_________(填序号),与⑧互为同分异构体的是___________(填序号),⑤与酸性高锰酸钾反应的产物是______________(填结构简式);
(二)实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图所示(铁架台、铁夹、酒精灯等未画出):
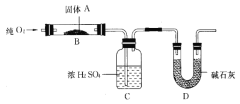
取17.1g A放入B装置中,持续通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(4)D装置的作用是____________________,有同学认为该套装置有明显的缺陷,需要改进,该同学判断的理由是___________________;
(5)装置改进后进行实验,若A的摩尔质量为342g/mol,C装置增重9.9g,D装置增重26.4 g,则A的分子式为_____________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,可逆反应N2 + 3H2![]() 2NH3 达到平衡状态的标志是
2NH3 达到平衡状态的标志是
A. N2、H2、NH3在容器中共存
B. 混合气体的总物质的量不再发生变化
C. 单位时间内生成n mol N2,同时生成3n mol H2
D. 单位时间内消耗n mol N2,同时消耗n mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是汽车安全气囊的主要成分,实验室制取叠氮化钠的实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。

(1)装置B中盛放的药品为____。
(2)步骤①中先加热通氨气一段时间的目的是____;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为____。步骤③中最适宜的加热方式为___(填“水浴加热”,“油浴加热”)。
(3)生成NaN3的化学方程式为____。
(4)产率计算
①称取2.0 g叠氮化钠试样,配成100 mL溶液,并量取10.00 mL溶液于锥形瓶中。
②用滴定管加入0.10 mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质均不参与反应)。
③充分反应后滴入2滴邻菲罗啉指示液,并用0.10 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00 mL(滴定原理:Ce4++Fe2+=Ce3++Fe3+)。计算可知叠氮化钠的质量分数为____(保留2位有效数字)。若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是____(填字母代号)。
A.锥形瓶使用叠氮化钠溶液润洗
B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数
C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内
(5)叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进行销毁,反应后溶液碱性明显增强,且产生无色无味的无毒气体,试写出反应的离子方程式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com