
【题目】二甲醚(![]() )是一种应用前景广阔的清洁燃科,以CO和氢气为原料生产二甲醚主要发生以下三个反应:
)是一种应用前景广阔的清洁燃科,以CO和氢气为原料生产二甲醚主要发生以下三个反应:
编号 | 热化学方程式 | 化学平衡常数 |
① |
|
|
② |
|
|
③ |
|
|
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 |
|
| C≡O | H-O | C-H |
| 436 | p>343 | 1076 | 465 | 413 |
由上述数据计算![]() __________________________________;
__________________________________;
(2)该工艺的总反应为![]() ,该反应
,该反应![]() _______________,化学平衡常数
_______________,化学平衡常数![]() ______________________(用含
______________________(用含![]() 的代数式表示);
的代数式表示);
(3)下列措施中,能提高![]() 产率的有______________________________;
产率的有______________________________;
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。该工艺中反应③的发生提高了![]() 的产率,原因是___________________________。
的产率,原因是___________________________。
(5)以![]() 通入
通入![]() 的反应器中,一定条件下发生反应:
的反应器中,一定条件下发生反应: ![]() ,其
,其![]() 的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是____________________;
的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是____________________;
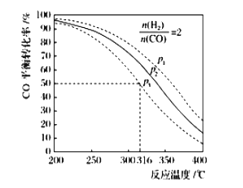
A.该反应的![]()
B.若在![]() 和
和![]() 时反应达到平衡,则CO的转化率小于50%
时反应达到平衡,则CO的转化率小于50%
C.若在![]() 和
和![]() 时反应达到平衡, 氢气的转化率等于50%
时反应达到平衡, 氢气的转化率等于50%
D.若在![]() 和
和![]() 时,起始时
时,起始时![]() ,则达平衡时CO的转化率大于50%
,则达平衡时CO的转化率大于50%
E.若在![]() 和
和![]() 时,反应达平衡后保持温度和压强不变,再充入
时,反应达平衡后保持温度和压强不变,再充入![]() 和
和![]() ,则平衡时二甲醚的体积分数增大
,则平衡时二甲醚的体积分数增大
(6)某温度下,将![]() 和
和![]() 充入容积为
充入容积为![]() 的密闭容器中,发生反应:
的密闭容器中,发生反应:![]() ,反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数
,反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数![]() ____________________________。
____________________________。
【答案】![]()
![]()
![]() AD 反应③消耗了反应②中的产物
AD 反应③消耗了反应②中的产物![]() ,使反应②的化学平衡向正反应方向移动,从而提高了
,使反应②的化学平衡向正反应方向移动,从而提高了![]() 的产率
的产率 ![]()
![]()
【解析】
(1)反应热=反应物总键能-生成物总键能,故△H1=1076kJ/mol+2×436kJ/mol-(3×413+343+465)kJ/mol=-99kJ/mol;
(2)已知①CO(g)+H2(g)═CH3OH(g) △H1=-99kJ/mol;
②2CH3OH(g)═CH3OCH3(g)+H2O △H2=-24kJ/mol;
③CO(g)+H2O(g)═CO2(g)+H2(g) △H3=-41kJ/mol,
利用盖斯定律,反应①×2+②+③,可得到反应3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)
△H=(-99kJ/mol)×2+(-24kJ/mol)+(-41kJ/mol)=-263kJ/mol,
则总方程的平衡常数等于分方程的平衡常数之积,即K=![]() ;
;
(3)A、分离出二甲醚,平衡右移,故可以提高新工艺中CH3OCH3产率,选项A选;
B、此反应为放热反应,升高温度平衡左移,CH3OCH3产率降低,选项B不选;
C、使用催化剂只能加快反应速率,不能使平衡移动,故改用高效催化剂不能改变CH3OCH3产率,选项C不选;
D.增大压强,平衡右移,故可以提高新工艺中CH3OCH3产率,选项D选;
答案选AD;
(4)新工艺中③的发生提高了CH3OCH3的产率,是因反应③能消耗反应②中的产物水,从而使反应②的平衡右移,故能提高CH3OCH3的产率,故答案为:反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反方应向移动,从而提高了CH3OCH3的产率;
(5)A.由图可知,压强一定时,温度越高,平衡时CO的转化率越低,说明升高温度平衡向逆反应方向移动,故正反应为放热反应,即△H<0,选项A错误;
B.以n(H2):n(CO)=2通入1L的反应器中,令n(H2)=2mol、n(CO)=1mol,n(H2)=n(CH3OCH3)时,设参加反应的氢气为xmol,则:
2CO(g)+4H2(g) ![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
0.5xmol xmol 0.25xmol
故2-x=0.25x,解得x=1.6,故CO的转化率=![]() ×100%=80%>50%,选项B错误;
×100%=80%>50%,选项B错误;
C.若在P3和316℃时,起始时n(H2):n(CO)=2,根据方程式,CO的转化率等于氢气的转化率等于50%,选项C正确;
D.若在P3和316℃时,起始时n(H2):n(CO)=3,相当于在原平衡的基础上增大氢气的浓度,平衡向正反应方向移动,CO的转化率增大,故CO转化率应大于50%,选项D正确;
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2 mol H2和1 mol CO,物质的量之比不变,平衡不移动,则平衡时二甲醚的体积分数不变,选项E错误;
答案选CD;
(6)设平衡时二甲醚的浓度为X,根据三段式可有:
2CO(g)+4H2(g) ![]() =25%,解得X=0.75mol/L
=25%,解得X=0.75mol/L
化学平衡常数K=![]() =2.25。
=2.25。


科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:_____________________________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2 中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
③NaH2PO2 为________(填“正盐”或“酸式盐”),其溶液显 ________(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a-Fe(III)晶面铁原子簇是合成氨工业的一种新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为①H2 (g)=2H(g) △H1,②N2(g)+2H(g)2(NH)(g) △H2, ③(NH)(g)+H(g)![]() (NH2)(g) △H3, ④(NH2)(g)+H(g)
(NH2)(g) △H3, ④(NH2)(g)+H(g) ![]() NH3 (g) △H4,总反应为N2 (g)+3H2(g)
NH3 (g) △H4,总反应为N2 (g)+3H2(g)![]() 2NH3 (g) △H。下列说法正确的是
2NH3 (g) △H。下列说法正确的是
A. 催化剂能够有效降低反应的活化能和改变反应的焓变
B. 增大压强和使用高效催化剂均有利于提高总反应的平衡转化率
C. 反应①和总反应均为放热反应
D. △H=3△H1+△H2+2△H3+2△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N。若向M、N溶液中逐滴加入浓度为0.25mol·L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B。
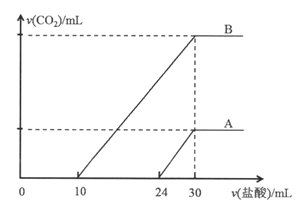
请回答下列问题:
(1)NaOH溶液的物质的量浓度为_____________。
(2)M、N两溶液中相同组分溶质的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中评价合理的是
选项 | 化学反应及其离子方程式 | 评 价 |
A | NaHSO4溶液与Ba(OH)2溶液反应至 SO42-沉淀完全: 2H++SO42-+Ba2++2OH- = BaSO4↓ + 2H2O | 正 确 |
B | 向碳酸镁溶液中加入足量稀盐酸: CO32-+2H+=CO2↑+H2O | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色: Fe3++3H2O = Fe(OH)3↓+3H+ | 正 确 |
D | NaOH溶液中通入少量CO2反应:OH-+CO2=HCO3- | 正 确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是

A. OH+HCl=H2O+ClB. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+Cu2+=Cu+Fe2+D. Fe+2H+=Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中 加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1))中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )
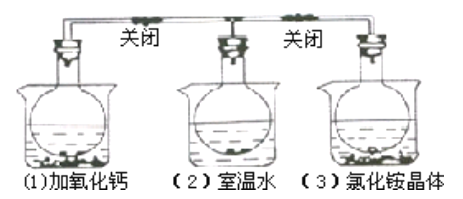
A. 2NO2![]() N2O4是放热反应
N2O4是放热反应
B. NH4Cl溶于水时放出热量
C. 烧瓶(1)中平衡混合气的平均相对分子质量增大
D. 烧瓶(3)中气体的压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物其结构简式为![]() ,关于该有机物下列叙述正确的是
,关于该有机物下列叙述正确的是
A. 在加热和催化剂作用下,1mol该有机物最多能和4mol H2反应
B. 不能使溴的CCl4溶液褪色
C. 不能使酸性KMnO4溶液褪色
D. 一定条件下,能和NaOH醇溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①写出基态Mn原子的价电子排布式为___________________________。在元素周期表中,该元素在________(填“s”“p”“d”“f”或“ds”)区。与Mn同周期的所有过渡元素的基态原子中,最外层电子数与Mn不同的元素有__________种。
②CO32-的空间构型是__________________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为___________________________________。
②CO2分子中C原子轨道的杂化类型为________________________________________。
③1 mol甲醛(HCHO)分子中含有的σ键数目为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com