
 ,试写出:
,试写出: .
. .
. .
. ,
, ,
, .
. 分析 (1)乳酸中含-OH和-COOH,当钠足量时,1mol乳酸能和2mol金属钠发生置换反应;
(2)乳酸中含-OH和-COOH,由于-COOH显酸性,而-OH不能电离,故-COOH中的氢原子比-OH中的氢原子更活泼,据此分析当钠少量时的反应;
(3)3分子乳酸在浓硫酸存在下发生酯化反应,据此分析生成的链状的产物;
(4)2分子乳酸在浓硫酸存在下发生分子间酯化成环;
(5)乳酸在浓硫酸存在下能发生缩聚反应生成高分子化合物;
(6)乳酸中的-OH所在碳原子的相邻碳原子上有氢原子,故能发生消去反应;由于所得的产物中含-COOH,故能与甲醇发生酯化反应,根据酸脱羟基醇脱氢来分析产物;酯化后的产物中由于含有碳碳双键,故能发生加聚反应,据此分析产物.
解答 解:(1)乳酸中含-OH和-COOH,当钠足量时,1mol乳酸能和2mol金属钠发生置换反应,化学方程式为:CH3CH(OH)COOH+2Na=H2+CH3CH(ONa)COONa,故答案为:CH3CH(OH)COOH+2Na=H2+CH3CH(ONa)COONa;
(2)乳酸中含-OH和-COOH,由于-COOH显酸性,而-OH不能电离,故-COOH中的氢原子比-OH中的氢原子更活泼,故当钠少量时,钠只与-COOH反应,化学方程式为:2CH3CH(OH)COOH+2Na=H2+CH3CH(OH)COONa,故答案为:2CH3CH(OH)COOH+2Na=H2+CH3CH(OH)COONa;
(3)乳酸中含-OH和-COOH,故3分子乳酸在浓硫酸存在下能分子间发生酯化反应,生成的链状的产物为 ,故答案为:
,故答案为: ;
;
(4)乳酸中含-OH和-COOH,2分子乳酸在浓硫酸存在下相互间的-OH和-COOH发生酯化反应,生成环状产物 ,故答案为:
,故答案为: ;
;
(5)由于乳酸中含-OH和-COOH,故分子间能发生酯化反应形成长链,即乳酸在浓硫酸存在下能发生缩聚反应生成高分子化合物 ,故答案为:
,故答案为: ;
;
(6)乳酸中的-OH所在碳原子的相邻碳原子上有氢原子,故能在浓硫酸做催化剂的条件下发生消去反应,产物的结构简式为 ;
;
由于所得的产物 中含-COOH,故能与甲醇发生酯化反应,根据酸脱羟基醇脱氢可知所得酯化反应的产物为
中含-COOH,故能与甲醇发生酯化反应,根据酸脱羟基醇脱氢可知所得酯化反应的产物为 ;由于酯化后的产物中由于含有碳碳双键,故能发生加聚反应,加聚的化学方程式为:
;由于酯化后的产物中由于含有碳碳双键,故能发生加聚反应,加聚的化学方程式为: ;
;
故答案为: ;
; ;
; .
.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构特点和官能团的性质,把握反应类型的判断,难度不大.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | CaCO3 $\stackrel{高温}{→}$CaO $\stackrel{{H}_{2}O}{→}$Ca(OH)2$→_{过滤}^{N{a}_{2}C{O}_{3}溶液}$ NaOH溶液 | |
| B. | Cu$→_{△}^{O_{2}}$CuO$→_{△}^{H_{2}SO_{4}}$CuSO4溶液$→_{过滤}^{NaOH溶液}$Cu(OH)2沉淀 | |
| C. | KMnO4$\stackrel{△}{→}$O2$\stackrel{s}{→}$SO2$\stackrel{{H}_{2}O}{→}$H2SO3 | |
| D. | BaCO3$\stackrel{盐酸}{→}$BaCl2溶液$\stackrel{NaOH溶液}{→}$Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
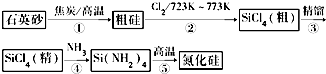
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6~10的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应至6min时,c(H2O2)=0.20mol/L | |
| D. | 反应至6min时,H2O2分解了40% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量 Fe 反应,转移的电子数为 3NA | |
| B. | 在常温常压下,1.7g NH3含有的原子数为 0.4NA | |
| C. | 标准状况下,11.2 L 水中含有的原子数是 1.5NA | |
| D. | 0.2 mol?L-1 的 Na2SO4溶液中含 Na+数目为 0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛待测液的锥形瓶用蒸馏水洗后未用待测液润洗 | |
| B. | 滴定管尖嘴部分在滴定前有气泡 | |
| C. | 滴定管在滴定前未将刻度调在“0.00”,而调在“2.40” | |
| D. | 滴定达终点时,滴定管尖嘴部分有气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水;无水氯化钙 | B. | 饱和NaHCO3溶;浓硫酸 | ||
| C. | 浓硫酸;饱和Na2CO3溶液 | D. | 饱和Na2CO3溶液;稀硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com