
C、S、O、Se是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Ge的原子核外电子排布式为
(2)C、Si、Sa三种元素的单质中,能够形成金属晶体的是
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式 ;
②SO2晶体的空间构型及硅氧之间的成键方式 ;
 ③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
(4)CO可以和很多金属形成配合物,如Ni(CO)2,Ni与CO之间的键型为
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-3,CO分子中碳氧键的伸缩振动频率为2143cm-2,则Ni(CO)中碳氧键的强度比CO分子中碳氧键的强度 (填字母)
A.强
B.弱
C.相等
D.无法判断
科目:高中化学 来源: 题型:阅读理解
 (2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题:
(2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题: →
→
 →
→


查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。请用元素符号或化学式填空:
(1)所示元素中
①非金属性最强的元素是:
②金属性最强的元素是:
③原子半径最小的是:
④最高价含氧酸酸性最强的是
⑤经常用作半导体材料的元素是: (只写一种)
⑥阴影部分属于元素周期表中的 族,该族元素的最高正价均为
(2)根据元素周期律,推导:
①酸性强弱: H3AsO4 H3PO4(用“>”或“<”表示,下同);
②稳定性:H2S HCl
③沸点:HF HCl
④还原性:I- Br-
⑤在O、F、S、Cl四种元素中,非金属性最接近的是:
A.O和F B.F和S C.S和Cl D.O和Cl
(3)根据同主族元素性质的相似性和递变性进行预测:
①关于Se的预测正确的是:
A. 常温下Se单质是气体
B. Se最高价氧化物的水化物能和NaOH发生反应
C. 氢化物的化学式为H2Se
D. 常见的氧化物只有SeO3
②已知Cl2在水溶液中能和SO2反应,Cl2+2H2O+SO2==H2SO4+2HCl,写出Br2在水溶液中和SO2反应的离子反应方程式___________________________________
查看答案和解析>>
科目:高中化学 来源:09~10年东莞市高一下学期期末考试化学卷 题型:填空题
(15分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。请用元素符号或化学式填空: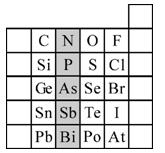
(1)所示元素中
①非金属性最强的元素是:
②金属性最强的元素是:
③原子半径最小的是:
④最高价含氧酸酸性最强的是
⑤经常用作半导体材料的元素是: (只写一种)
⑥阴影部分属于元素周期表中的 族,该族元素的最高正价均为
(2)根据元素周期律,推导:
①酸性强弱: H3AsO4 H3PO4(用“>”或“<”表示,下同);
②稳定性:H2S HCl
③沸点:HF HCl
④还原性:I- Br-
⑤在O、F、S、Cl四种元素中,非金属性最接近的是:
A.O和F B.F和S C.S和Cl D.O和Cl
(3)根据同主族元素性质的相似性和递变性进行预测:
①关于Se的预测正确的是:
A. 常温下Se单质是气体
B. Se最高价氧化物的水化物能和NaOH发生反应
C. 氢化物的化学式为H2Se
D. 常见的氧化物只有SeO3
②已知Cl2在水溶液中能和SO2反应,Cl2+2H2O+SO2==H2SO4+2HCl,写出Br2在水溶液中和SO2反应的离子反应方程式___________________________________
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市杨浦区高三上学期期中考试化学试卷(解析版) 题型:填空题
四种短周期元素A、B、C、D的性质或结构信息如下。

信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
甲:是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分。
乙:无色,无味而易燃,是21世纪的主要能源。
丙:有强氧化性,可以用于消毒杀菌。请根据上述信息回答下列问题。
(1)丙 (写化学式)写出其分子的的电子式 。
(2)写出A原子最外层电子排布式 。将该元素的单质溶于水,形成的平衡体系中所有离子的浓度按由大到小排序:
(3)B形成的单质晶体可能为 。
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
(4)C的同主族元素的单质及其化合物的性质存在着相似性和递变性。下列有关说法正确的是____
A.其气态氢化物的稳定性按H2O、H2S、H2Se、H2Te的顺序依次减弱
B.其氢化物中的键长按O—H、S—H、Se—H、Te—H的顺序依次减小
C.其氢化物的沸点按H2O、H2S、H2Se、H2Te的顺序依次增强
D.其阴离子的还原性按O2–、S2–、Se2–、Te2–的顺序依次增强
(5)与氩原子质子数和电子数均相同的微粒有HCl、H2S、PH3、SiH4,以及还有_______ 、___________等(例举两种即可)
查看答案和解析>>
科目:高中化学 来源:09-10年东莞市高一下学期期末考试化学卷 题型:填空题
(15分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。请用元素符号或化学式填空:
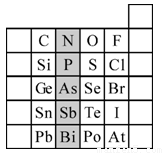
(1)所示元素中
①非金属性最强的元素是:
②金属性最强的元素是:
③原子半径最小的是:
④最高价含氧酸酸性最强的是
⑤经常用作半导体材料的元素是: (只写一种)
⑥阴影部分属于元素周期表中的 族,该族元素的最高正价均为
(2)根据元素周期律,推导:
①酸性强弱: H3AsO4 H3PO4(用“>”或“<”表示,下同);
②稳定性:H2S HCl
③沸点:HF HCl
④还原性:I- Br-
⑤在O、F、S、Cl四种元素中,非金属性最接近的是:
A.O和F B.F和S C.S和Cl D.O和Cl
(3)根据同主族元素性质的相似性和递变性进行预测:
①关于Se的预测正确的是:
A. 常温下Se单质是气体
B. Se最高价氧化物的水化物能和NaOH发生反应
C. 氢化物的化学式为H2Se
D. 常见的氧化物只有SeO3
②已知Cl2在水溶液中能和SO2反应,Cl2+2H2O+SO2==H2SO4+2HCl,写出Br2在水溶液中和SO2反应的离子反应方程式___________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com