
【题目】为验证卤素单质氧化性的相对较弱,某小组用下图装置进行实验(夹持仪器已略去,气密性已检验)。实验过程:

Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸,A中产生黄绿色气体。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)D中四氯化碳的电子式是 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B中溶液发生反应的离子方程式是 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 。
(5)过程Ⅲ实验的目的是 。
【答案】(1)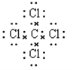 (1分)
(1分)
(2)淀粉KI试纸变蓝 (1分) (3)Cl2+2Br- =Br2+2Cl- (1分)
(4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,(取下D震荡) (2分)
静置后CCl4层溶液(或下层溶液,1分)变为紫红色。(1分) 本小题共4分
(5)确认C的黄色溶液中无Cl2,(1分)排除Cl2对溴置换碘实验的干扰。(2分)
【解析】
试题分析:(1)四氯化碳是共价化合物,含有极性键,电子式是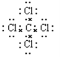 。
。
(2)氯气具有氧化性,能把碘化钾氧化生成单质碘,碘与淀粉性蓝色,所以实验现象是淀粉KI试纸变蓝。
(3)氯元素的非金属性强于溴元素的非金属性,所以氯气能和溴化钠反应生成单质溴,反应的离子方程式是Cl2+2Br- =Br2+2Cl-。
(4)由于C中有单质溴生成,所以要验证溴的氧化性强于碘,过程Ⅳ的操作和现象分别是打开活塞b,将少量C中溶液滴入D中,关闭活塞b,(取下D震荡) ,静置后CCl4层溶液(或下层溶液,1分)变为紫红色。
(5)由于氯气也能氧化碘化钾,干扰单质溴和碘化钾的反应,所以过程Ⅲ实验的目的是确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰。


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】下列关于硫酸铜溶液和氢氧化铁胶体的说法中,正确的是
A. 前者是混合物,后者是纯净物 B. 两者都具有丁达尔效应
C. 分散质的粒子直径均在1~100nm之间 D. 前者可用于杀菌,后者可用于净水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
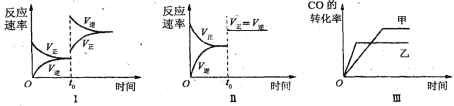
下列分析中不正确的是( )
A.图Ⅰ研究中的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.01 molNH4Cl和0.005mol NaOH溶于水配成1 L 溶液(Ph>7).
(1)该溶液中存在的三个平衡体系是: __ _____、__ ____、_____________。
(2)溶液中存在的离子物质的量浓度由大到小顺序为 。
(3)这些粒子中浓度为0.01 mol/L 的是_________,浓度为0.005 mol/L 的是_________。
(4)物质的量之和为0.01 mol的两种粒子是:_________________________。
(5)NH4+和H+两种离子数量之和比OH-多_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系。下列有关物质的推断不正确的是
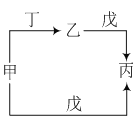
A.若甲为Na,则戊可能是H2O
B.若甲为C2H4,则戊可能是O2
C.若甲为NO,则戊可能是H2O
D.若甲为Cl2,则戊可能是NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
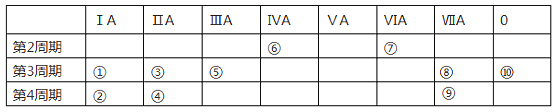
(1)10种元素中,化学性质最不活泼的是________________。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是___________。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是____________。
(4)元素⑦的氢化物常温下和元素⑧的单质反应的化学方程式为:____________。
(5)①和⑨两种元素形成化合物的化学式为_________,该化合物溶液与元素⑧的单质反应的化学方程式为_______________。
(6)已知元素的电负性与元素的化合价一样,也是J已索的一种基本性质。下面给出14种元素的电负性。
元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
电负性 | 1.5 | 2 | 1.5 | 2.5 | 2.8 | 4 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,推测元素的电负性的变化规律是:_________,_________。
(2)预测Br与I元素电负性的大小关系_________,前四周期中,电负性最小的元素是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com