
检验SO2气体中是否混有CO2气体,可采用的方法是( )
A.通过澄清石灰水
B.先通过饱和NaHCO3溶液,再通过澄清石灰水
C.先通过NaOH溶液,再通过澄清石灰水
D.先通过酸性KMnO4溶液,再通过品红溶液,最后通过澄清石灰水
 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
在氢、氮、氯和钠四种元素中:
(1)有2种元素组成的共价化合物的水溶液显酸性,这种化合物的电子式是
;
(2)有2种元素可形成离子化合物,用子电式表示其形成过程:
;
(3)在它们可能形成的双原子分子的单质中,化学性质最稳定的是:
。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 ( )
A.PM 2.5的产生和成分比较复杂,但主要与人类活动有关
B.向氯乙烷中加入硝酸酸化的AgNO3溶液来检验Cl-
C.酒精可使蛋白质变性,故能消毒杀菌
D.塑化剂是一种化工塑料软化剂,可以大量添加到婴幼儿玩具中
查看答案和解析>>
科目:高中化学 来源: 题型:
某芳香族化合物A的水溶液显酸性,测得A分子中无酚羟基.A可发生下图所示转化,其中F为五元环状化合物;G可使溴的四氯化碳溶液褪色;F和G互为同分异构体;H和I都是医用高分子材料。
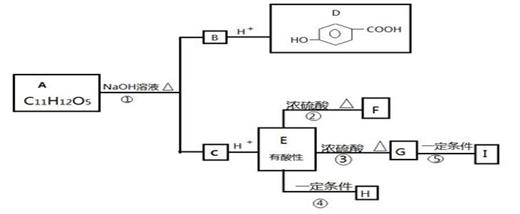
请回答:
(1)反应②的化学方程式是 .
(2)(2)A与H的结构简式分别是 、 .
(3)D与足量X溶液反应后可得到C7H5O3Na,则X溶液中所含溶质的化学式是 .
(4)符合下列条件的G的同分异构体中的反式结构的结构简式
.
①能发生水解反应 ②分子中不含环状结构 ③分子中有4种不同化学环境的氢原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.为了消除碘缺乏病,在食盐中必须加入一定量的单质碘
B.新制氯水中含有的分子包括Cl2、H2O,含有的离子包括H+、Cl-、ClO-
C.新能源汽车的推广与使用有助于减少光化学烟雾的产生
D.PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是
A.NaHCO3溶液与盐酸:CO32− + 2 H+ = H2O + CO2↑
B.硝酸银溶液与铜:Cu + Ag+ = Cu2+ + Ag
C.向硝酸亚铁溶液中加入稀硫酸:Fe2++4H++NO3-=Fe3++NO↑+2H2O
D.用醋酸除水垢:2CH3COOH + CaCO3 = Ca2+ + 2CH3COO− + H2O + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸铵是一种常用的化肥,其工业生产流程如下图,请回答下列问题。
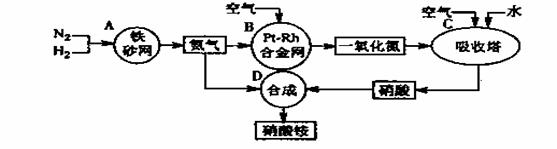
⑴写出反应容器B中发生反应的化学方程式: 。
⑵吸收塔C中通入空气的目的是 ;A、B、C、D四个反应容器中发生的反应,属于氧化还原反应的是 (填反应容器代号)。
⑶浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因: 。
⑷金属铜与浓硝酸反应的离子方程式是 ,该反应中浓硝酸表现的性质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:

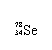
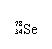
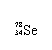 Se是人体必需的微量元素,下列有关 和 的说法正确的是
Se是人体必需的微量元素,下列有关 和 的说法正确的是
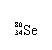
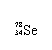
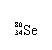
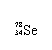 A. 和 互为同位素 B. 和 都含有34个中子
A. 和 互为同位素 B. 和 都含有34个中子
C. 和 分别含有44和46个质子 D. 和 含有相同的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 ▲ 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。
|
 写出该电池的负极反应式: ▲ 。
写出该电池的负极反应式: ▲ 。 (3)CO2和H2充入一定体积的密闭容器中,在两种温度
下发生反应:
CO2(g) +3H2(g) CH3OH(g) +H2O(g)
CH3OH(g) +H2O(g)
|
|
(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 ▲ 。
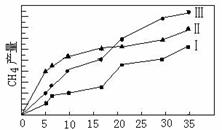
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化见图11。在0~15小时内,CH4的平均生成速率I、II和III从大到小的顺序为 ▲ (填序号)。
|
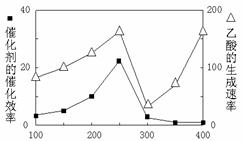
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图12。
①乙酸的生成速率主要取决于温度影响的范围是 ▲ 。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式: ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com