
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
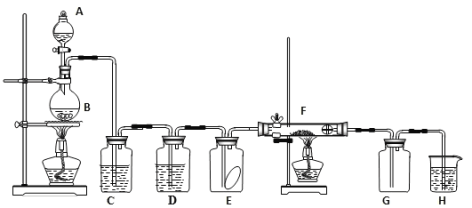
(1)装置C中盛装的溶液是____________,D中试剂的作用是____________________。
(2)E中的红色布条是否褪色?____(填“是”或“否”),写出F中反应的化学反应方程式:____________________,其反应现象为__________________________。
(3)H中的试剂为___________,用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,该反应的化学方程式为_________________________。
(4)8.7gMnO2固体与足量浓盐酸充分反应,在标准状况下产生Cl2的体积为_____L;其中被氧化的HCl的物质的量为_______mol。
【答案】饱和食盐水 干燥气体 否 Cu+Cl2![]() CuCl2 出现棕黄色的烟 NaOH溶液 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2.24 0.2
CuCl2 出现棕黄色的烟 NaOH溶液 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2.24 0.2
【解析】
实验室制用二氧化锰和浓盐酸共热取氯气,浓盐酸具有挥发性,则需要除去氯化氢和水蒸气,装置C为饱和食盐水,为除去HCl杂质;装置D为浓硫酸,除去水蒸气;装置E为验证干燥的氯气无漂白性;装置F为验证铜与氯气反应;H为吸收未反应的氯气。
(1)装置C为除HCl气体的装置,盛装饱和食盐水;装置D为干燥装置,除去氯气中的水蒸气;
(2)E中为干燥的红色布条,且通入干燥的氯气,则红色布条不褪色;F中为铜与氯气反应生成氯化铜,方程式为Cu+Cl2![]() CuCl2,硬质双通玻璃管中出现棕黄色的烟;
CuCl2,硬质双通玻璃管中出现棕黄色的烟;
(3)H为吸收未反应的氯气,试剂为NaOH溶液;工业上用石灰乳与氯气反应生成氯化钙、次氯酸钙和水,方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)8.7gMnO2,即0.1mol,根据MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,生成氯气的物质的量为0.1mol,即标况下的2.24L;其中被氧化的即化合价降低的HCl的物质的量为0.2mol。
MnCl2+Cl2↑+2H2O,生成氯气的物质的量为0.1mol,即标况下的2.24L;其中被氧化的即化合价降低的HCl的物质的量为0.2mol。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=98 kJ·mol1。回答下列问题:
SO3(g) ΔH=98 kJ·mol1。回答下列问题:
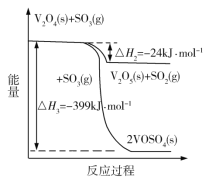
(1)钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:_________。
(2)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α 随温度的变化如图所示。反应在5.0MPa、550℃时的α=__________,判断的依据是__________。影响α的因素有__________。

(3)将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为___________,平衡常数Kp=___________(以分压表示,分压=总压×物质的量分数)。
(4)研究表明,SO2催化氧化的反应速率方程为:v=k(![]() 1)0.8(1nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图所示。
1)0.8(1nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图所示。
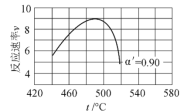
曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。t<tm时,v逐渐提高;t>tm后,v逐渐下降。原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年1月《自然》杂志报道了中科大的研究人员利用直接电解将二氧化碳高效、清洁地转化成液体甲酸燃料的最新成果。下列有关说法不正确的是( )
A.甲酸又称蚁酸,自然界中蚂蚁等昆虫可以分泌甲酸
B.甲酸和油酸含有的官能团相同
C.CO2转变为HCOOH发生还原反应
D.甲酸能发生酯化反应,也能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.22.4 L(标准状况)氮气中含有7NA个中子
B.1 mol重水比1 mol水多NA个质子
C.12 g石墨烯和12 g金刚石均含有NA个碳原子
D.1 L 1 mol·L1 NaCl溶液含有28NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种高性能的碱性硼化钒(VB2)—空气电池如下图所示,其中在VB2电极发生反应:![]() 该电池工作时,下列说法错误的是
该电池工作时,下列说法错误的是

A.负载通过0.04 mol电子时,有0.224 L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为![]()
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯是重要的化工原料,利用乙苯为初始原料合成高分子化合物J的流程如图所示(部分产物及反应条件已略去):

已知:①R1CHO+R2CH2CHO![]() +H2O
+H2O
②
请回答下列问题:
(1)物质B的名称为____;F的结构简式为____;
(2)②、③的反应类型分别为____、____;
(3)物质H中官能团的名称是____;
(4)反应④的化学方程式为____;
(5)与G互为同分异构体,符合下列条件的芳香族化合物共有____种;
ⅰ.遇FeCl3显紫色
ⅱ.含碳碳叁键
(6)参照上述合成路线和信息,设计![]() 、乙醛、苯甲醇为原料合成
、乙醛、苯甲醇为原料合成 的路线(无机试剂任选)____。
的路线(无机试剂任选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)梯恩梯(TNT)结构简式为__。
(2)![]() 中含有的官能团的名称为__。
中含有的官能团的名称为__。
(3)戊烷的某种同分异构体只有一种一氯代物,试书写它的结构简式__。
(4)某炔烃和氢气充分加成生成2,2,5-三甲基己烷,该炔烃的结构简式是__,名称是__。
(5)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为__。
(6)分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体混合物X可能含有NaNO2、Na2SiO3、FeCl3、KAlO2中的一种或几种物质,某同学对该固体进行了如下实验:

下列判断正确的是
A.溶液甲中一定含有NaNO2、Na2SiO3,可能含有FeCl3、KAlO2
B.原固体混合物X中一定有KAlO2
C.固体乙、固体丁一定是纯净物
D.将溶液乙和溶液丁混合一定有无色气体生成,可能有白色沉淀生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com