
| A. | 都是Al2O3 | B. | 依次为AlCl3、Al2(SO4)3 | ||
| C. | 都是Al(OH)3 | D. | 依次为Al2O3、Al2(SO4)3 |
分析 氯化铝溶液中铝离子水解生成氢氧化铝和盐酸,溶液显酸性,水解过程为吸热反应,加热促进水解,蒸干得到水解产物,灼烧时生成的氢氧化铝分解生成氧化铝,硫酸铝溶液中铝离子水解,反应生成硫酸和氢氧化铝,水解过程为吸热反应,加热促进水解,蒸干是蒸发的水,最后得到硫酸铝固体;
解答 解:氯化铝为强酸弱碱盐,水解出Al(OH)3和HCl:AlCl3+3H2O?Al(OH)3+HCl,而HCl是挥发性酸,受热挥发会导致水解平衡右移,导致AlCl3彻底水解为Al(OH)3,灼烧时Al(OH)3又会分解为Al2O3,故将氯化铝溶液蒸干并灼烧得到的固体物质是Al2O3;Al2(SO4)3是强酸弱碱盐,水解出H2SO4和Al(OH)3,而H2SO4是不挥发性酸,受热不能挥发,即Al2(SO4)3的水解不能彻底,故最终得到的即为Al2(SO4)3,故D正确,
故选D.
点评 本题考查了盐类水解的应用等知识点,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意把握水解的原理、影响因素和盐类溶液蒸干得到的固体成分分析,题目难度中等.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
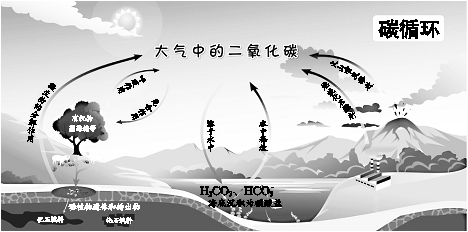
| A. | 呼吸作用涉及氧化还原反应 | B. | 碳循环具有全球性 | ||
| C. | 含碳化合物可相互转化 | D. | 碳元素均被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:Ca(OH)2>Mg(OH)2 | B. | 酸性:H3BO3>H2CO3 | ||
| C. | 热稳定性:NH3<PH3 | D. | 还原性:S2-<F- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁带中混有与酸不反应的杂质 | |
| B. | 装置接口连接处有气体泄漏 | |
| C. | 液体量瓶刻度读数未扣去硫酸的体积 | |
| D. | 硫酸注入量不足,镁带未反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
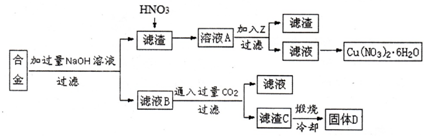
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、SO42-、Cl- | B. | K+、OH-、HCO3- | C. | Mg2+、SO42-、Cl- | D. | Cu2+、H+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com