

A.硒在空气中燃烧生成SeO2,和钠反应生成Na2Se | B.硒化氢有恶臭味,有毒,比硫化氢易分解 | C.硒化氢在空气中不能燃烧 | D.亚硒酸(H2SeO3)是一种弱酸 |
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.全部 | B.①②⑤⑥ | C.①②⑤ | D.③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4Cl+KNH2=KCl+2NH3↑ |
| B.M+2NH3=M(NH2)2+H2↑(M为二价活泼金属) |
| C.2NH4Cl+MNH=MCl2+NH3 |
| D.2NH4Cl+MO=M(NH2)2+2HCl+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
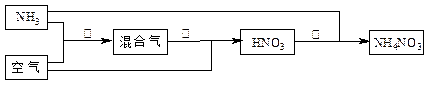
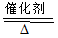 4NO+6H2O
4NO+6H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
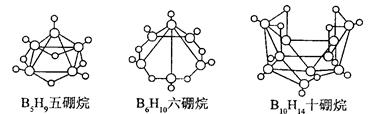
| A.这类巢式硼烷的通式是 C nH n + 4 |
B.2B5H9 + 12O2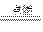 5B2O3 十9H2O ,l molB5H9完全燃烧转移25mol电子 5B2O3 十9H2O ,l molB5H9完全燃烧转移25mol电子 |
| C.8 个硼原子的巢式棚烷化学式应为 B8H10 |
| D.硼烷与水反应是非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | a | b | c |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | CH2=CH2 | CH3CH2OH | CH3CHO |
 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
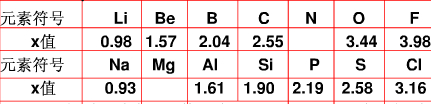
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com