
某厂平均每天产生约600 m3废氨水(NH3 的浓度为153 mg·L-1,密度为1 g·cm—3。
(1)该废氨水中氨的物质的量浓度为 。
(2)对废氨水进行加热蒸发得到NH3,使废氨水中的NH3 的浓度降为17 mg·L-1。忽略蒸发前后废氨水体积变化,则上述体积的废氨水蒸发出来的NH3的物质的量为 。(以下计算结果均保留两位小数)
(3)蒸发得到的NH3可用于制备NO。4NH3+5O2 →4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80。
①为使NH3恰好完全氧化为NO,氨—空气混合物中氨的体积分数为________。
②氨催化氧化制取NO同时会发生副反应:4NH3+3O2 →2N2+6H2O。将1L NH3混合10L空气后通入反应器,反应完成后,测得混合气体中不含NH3,而O2和N2的物质的量之比为1∶10,试求参加主反应的氨占原料氨的体积百分含量。
(4)废氨水可用于脱除烟气中的SO2。氨水吸收烟气中SO2经氧化后生成(NH4)2SO4和NH4HSO4混合物。现称取不同质量的混合物进行实验,结果如下:
|
NaOH 溶液体积/mL |
40.00 |
40.00 |
40.00 |
|
样品质量/g |
7.75 |
15.50 |
23.25 |
|
氨气质量/g |
1.87 |
1.87 |
1.7 |
试计算生成氨气的质量最大时样品的质量。
(1)9×10-3 mol·L-1 (2分)
(2)n(NH3)=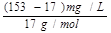 ×10-3g/mg×600m3×103L/m3=4800
mol (3分)
×10-3g/mg×600m3×103L/m3=4800
mol (3分)
(3)①0.14 (3分)
②设参加主反应NH3的为xmol,副反应的NH3为ymol
4NH3+ 5O2 →4NO+6H2O 4NH3 + 3O2 →2N2+6H2O
4 5 4 3 2
X 5x/4 y 3y/4 y/2
X+y=1 (2-5x/4-3y/4):(8+y/2)=1:10 x=0.89 (4分)
(4)7.75g混合肥料中n[(NH4)2SO4]=0.05mol,n(NH4HSO4)=0.01mol;则混合物溶解后,溶液中n(NH4+)∶n(H+)=11∶1。40.00 mL NaOH 溶液中n(NaOH)=0.13mol。n(H+)+ 11×n(H+)=0.13mol;n(H+)=0.13/12= n(NH4HSO4),n[(NH4)2SO4]= 5×0.13/12mol
混合物质量为8.40g。(4分)(其他合理解法也给分)
【解析】
试题分析:(1)进行单位变换:C(NH3)=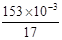 =9×10-3
mol·L-1 。(2)n(NH3)=
=9×10-3
mol·L-1 。(2)n(NH3)=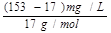 ×10-3g/mg×600m3×103L/m3=4800
mol (3分)(3)①氨和氧气的体积比为4:5,氨和空气的比值为4:25,则氨所占比例为:
×10-3g/mg×600m3×103L/m3=4800
mol (3分)(3)①氨和氧气的体积比为4:5,氨和空气的比值为4:25,则氨所占比例为: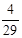 =0.14 。
=0.14 。
②设参加主反应NH3的为xmol,副反应的NH3为ymol
4NH3+ 5O2 →4NO+6H2O 4NH3 + 3O2 →2N2+6H2O
4 5 4 3 2
X 5x/4 y 3y/4 y/2
X+y=1 (2-5x/4-3y/4):(8+y/2)=1:10 x=0.89
(4)7.75g混合肥料中n[(NH4)2SO4]=0.05mol,n(NH4HSO4)=0.01mol;则混合物溶解后,溶液中n(NH4+)∶n(H+)=11∶1。40.00 mL NaOH 溶液中n(NaOH)=0.13mol。n(H+)+ 11×n(H+)=0.13mol;n(H+)=0.13/12= n(NH4HSO4),n[(NH4)2SO4]= 5×0.13/12mol,混合物质量为8.40g。
考点:本题考查化学平衡的计算,题目较为综合,且难度较大,在计算中要适当采用元素守恒。


科目:高中化学 来源:2012年苏教版高中化学必修2 2.2化学反应中的热量练习卷(带解析) 题型:填空题
沼气是一种廉价的能源。农村富有秸秆、杂草等废弃物,它们经微生物发酵之后,便可以产生沼气,可以用来点火做饭。
(1)煤的主要成分是碳,写出煤和沼气中的主要成分燃烧过程的化学方程式:
、 ;并指出哪一种燃料对环境的污染小? 。
(2)我国农村大约有700万个沼气发生池,如果每个沼气池平均每天产生2立方米的沼气(主要是甲烷),1mol甲烷完全燃烧能放出890kJ的热量,计算每天可节约燃烧值为3.36×107J·kg-1的标准煤多少千克?
查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学必修2 2.2化学反应中的热量练习卷(解析版) 题型:填空题
沼气是一种廉价的能源。农村富有秸秆、杂草等废弃物,它们经微生物发酵之后,便可以产生沼气,可以用来点火做饭。
(1)煤的主要成分是碳,写出煤和沼气中的主要成分燃烧过程的化学方程式:
、 ;并指出哪一种燃料对环境的污染小? 。
(2)我国农村大约有700万个沼气发生池,如果每个沼气池平均每天产生2立方米的沼气(主要是甲烷),1mol甲烷完全燃烧能放出890kJ的热量,计算每天可节约燃烧值为3.36×107J·kg-1的标准煤多少千克?
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知(C6H10O5)n+nH2O![]() 3nCO2+3nCH4+能量,请设想出这个总反应的实际价值与意义______________________________。
3nCO2+3nCH4+能量,请设想出这个总反应的实际价值与意义______________________________。
(2)煤的主要成分是碳,写出煤和沼气中的主要成分燃烧过程的化学方程式______________________;哪一种燃料对环境污染大?______________________________。
(3)我国农村大约有700万个沼气发生池,如果每个沼气池平均每天产生2 m3沼气(主要是CH4),每摩尔CH4完全燃烧能放出890 kJ的热量。计算每天可节约燃烧值为3.36×107 J·kg-1的标准煤多少千克?并说明使用沼气发生池还有哪些优点。
(4)若建立沼气发电站,可以实现把__________能转化成电能,沼气被称为______能源。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com