
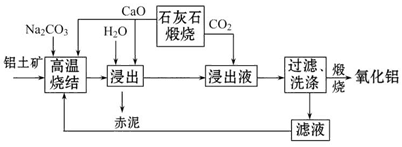
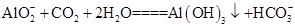
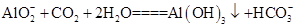 。
。

科目:高中化学 来源:不详 题型:填空题
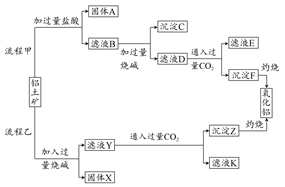
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4AlCl3(g)+3O2(g) ΔH>0 。下列分析错误的是( )
4AlCl3(g)+3O2(g) ΔH>0 。下列分析错误的是( )| A.增大反应体系的压强,反应速率可能加快 |
| B.加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量 |
| C.电解熔融的Al2O3和AlCl3溶液均能得到单质铝 |
| D.将AlCl3·6H2O在氯化氢气流中加热,也可制得无水氯化铝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xFe2O3的铝灰制备Al2(S04)3
xFe2O3的铝灰制备Al2(S04)3 18H2O,工艺流程如下:
18H2O,工艺流程如下: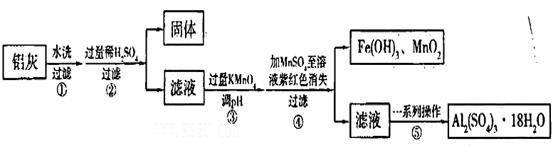
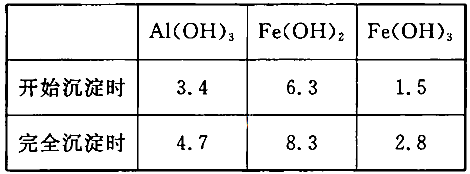
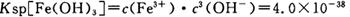 当pH=2时,Fe3+开始沉淀的浓度为_______________。
当pH=2时,Fe3+开始沉淀的浓度为_______________。| A.蒸发皿 | B.坩埚 | C.玻璃棒 | D.酒精灯E.漏斗 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 第一份 | 加入0.5 g水 | 很快产生火花 |
| 第二份 | 加入1 g胆矾 | 约需30 s产生火花 |
| 第三份 | 加入1 g无水硫酸铜 | 1 min时仍没有明显反应现象 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.6:1 | B.3:1 | C.2:1 | D.1:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝在常温下不能与氧气反应 | B.铝不能与氯气反应 |
| C.氧化铝只能与酸反应,不能与碱反应 | D.铝既能溶于酸,又能溶于强碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com