
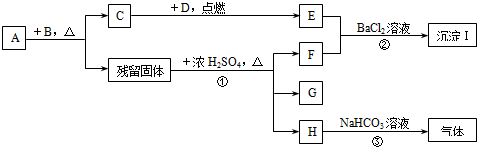
分析 C、D、E和F在常温下都是气体,D具有臭鸡蛋气味,则D应为H2S,硫化氢能在氧气点燃生成E,则C应为O2,所以E为SO2,晶体A的焰色反应为紫色,说明A中含有钾元素,其中B是黑色固体,A、B加热的条件下生成氧气,所以A为KClO3,B为二氧化锰,残留的固体中含有二氧化锰和氯化钾,二氧化锰和氯化钾及浓硫酸在加热的条件下生成F,F能使二氧化硫与氯化钡产生沉淀,则F有氧化性,所以F为氯气,H能与碳酸氢钠溶液产生气体,则H中含有氢离子,所以H应为硫酸氢钠,则G为氯化锰,据此答题;
解答 解:C、D、E和F在常温下都是气体,D具有臭鸡蛋气味,则D应为H2S,硫化氢能在氧气点燃生成E,则C应为O2,所以E为SO2,晶体A的焰色反应为紫色,说明A中含有钾元素,其中B是黑色固体,A、B加热的条件下生成氧气,所以A为KClO3,B为二氧化锰,残留的固体中含有二氧化锰和氯化钾,二氧化锰和氯化钾及浓硫酸在加热的条件下生成F,F能使二氧化硫与氯化钡产生沉淀,则F有氧化性,所以F为氯气,H能与碳酸氢钠溶液产生气体,则H中含有氢离子,说明浓硫酸过量,所以H应为硫酸氢钠,则G为硫酸锰,
(1)根据上面的分析可知,A为KClO3,C为O2,G为MnSO4,
故答案为:KClO3;O2;MnSO4;
(2)反应②的离子方程式为SO2+Cl2+Ba2++2H2O═BaSO4↓+2Cl-+4H+,反应③的离子方程式为H++HCO3-=CO2↑+H2O,
故答案为:SO2+Cl2+Ba2++2H2O═BaSO4↓+2Cl-+4H+;H++HCO3-=CO2↑+H2O.
点评 本题考查无机物推断,涉及氯、硫及其化合物的转化,突破口为“B是黑色固体,D具有臭鸡蛋气味”,再结合转化关系推断,难度不大,注意基础知识的掌握.


科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1LpH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | |
| B. | 室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2NA | |
| C. | 0.1molFe在0.1molCl2中充分燃烧,转移的电子数为0.3NA | |
| D. | 标准状况下,22.4LCCl4中含有的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
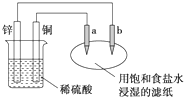
| A. | a为阳极,发生氧化反应:锌为负极被还原 | |
| B. | 电路中电子流动方向:锌→b→a→铜 | |
| C. | 电路中通过0.2mol电子,铜片上产生2.24L气体 | |
| D. | 往滤纸上滴加酚酞,b极附近颜色变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁皮未及时取出,会导致测定结果偏小 | |
| B. | 铁皮未洗涤干净,会导致结果偏大 | |
| C. | 把盐酸换成稀硫酸,会导致结果偏大 | |
| D. | 烘干时间过长,会导致结果偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
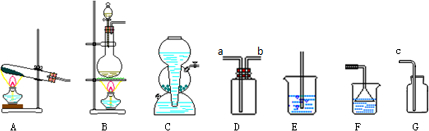
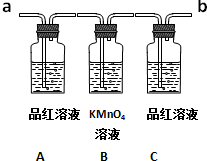 已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4用如图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2
已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4用如图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | 固体的NaCl不导电,熔融态的NaCl可以导电 | |
| C. | 根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间 | |
| D. | “血液透析”原理与胶体的性质无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com