
有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E﹤A, R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素, Z原子核外电子数为24。
请回答下列问题:
(1)基态Z原子的核外电子排布式是 。AE2+与二氧化碳分子互为等电子体,AE2+的电子式是____。AX3 分子的VSEPR模型是 。
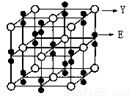
(2)某化合物由E、Y两种元素组成,其晶胞如图,该化合物的化学式为______。
(3)在化合物Y2ZE4的水溶液入适量硫酸,能观察到的现象是 。
(4)A的简单氢化物极易溶于E的简单氢化物,其原因是 。
(5)A的最高价氧化物对应水化物的稀溶液与R的单质反应时,A被还原到最低价,该反应的化学方程式是 。
(1)1s22s22p63s23p63d54s1或[Ar])3d54s1(2分)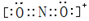 (2分)四面体(1分)
(2分)四面体(1分)
(2)KO2(2分)
(3)溶液由黄色变成橙色 (2分)
(4)NH3、H2O都是极性分子,且它们分子间还能形成氢键(2分)
(5)8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O (3分)
【解析】
试题分析:根据题给信息知,A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,则A为氮元素;原子的第一电离能E﹤A,结合题给信息知E为氧元素; R是地壳中含量最高的金属元素,则R为铝元素;X原子核外的M层中有三对成对电子,则X为氯元素;Y为周期表前四周期中电负性最小的元素,则Y为钾元素; Z原子核外电子数为24,则铬元素。(1)Z为铬元素,基态铬原子的核外电子排布式是1s22s22p63s23p63d54s1或[Ar])3d54s1;NO2+与二氧化碳分子互为等电子体,根据二氧化碳的电子式写出NO2+的电子式是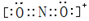 ;NCl3 的中心价电子对数为4,分子的VSEPR模型是四面体;(2)某化合物由O、K两种元素组成,根据其晶胞结构利用切割法分析,1个晶胞中含有8个O,4个K,该化合物的化学式为KO2;(3)在化合物K2CrO4的水溶液入适量硫酸,发生的反应为2H++CrO42—===Cr2O72—+H2O,能观察到的现象是溶液由黄色变成橙色;(4)A的简单氢化物NH3极易溶于E的简单氢化物H2O,其原因是NH3、H2O都是极性分子,且它们分子间还能形成氢键;(5)A的最高价氧化物对应水化物HNO3的稀溶液与铝单质反应时,氮元素被还原到最低价,生成硝酸铝、硝酸铵和水,该反应的化学方程式是8Al + 30HNO3 = 8Al(NO3)3
+ 3NH4NO3 + 9H2O。
;NCl3 的中心价电子对数为4,分子的VSEPR模型是四面体;(2)某化合物由O、K两种元素组成,根据其晶胞结构利用切割法分析,1个晶胞中含有8个O,4个K,该化合物的化学式为KO2;(3)在化合物K2CrO4的水溶液入适量硫酸,发生的反应为2H++CrO42—===Cr2O72—+H2O,能观察到的现象是溶液由黄色变成橙色;(4)A的简单氢化物NH3极易溶于E的简单氢化物H2O,其原因是NH3、H2O都是极性分子,且它们分子间还能形成氢键;(5)A的最高价氧化物对应水化物HNO3的稀溶液与铝单质反应时,氮元素被还原到最低价,生成硝酸铝、硝酸铵和水,该反应的化学方程式是8Al + 30HNO3 = 8Al(NO3)3
+ 3NH4NO3 + 9H2O。
考点:考查元素推断和元素的性质,涉及原子结构、分子结构和晶体结构及相关物质的性质。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| 催化剂 |
| NaOH |
| △ |
| NaOH |
| △ |
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| X | 中和反应 | 无现象 | 溶 解 | 产生氢气 |
| Y | 无现象 | 有银镜 | 加热后有红色沉淀 | 产生氢气 |
| Z | 水解反应 | 有银镜 | 加热后有红色沉淀 | 无现象 |
| W | 水解反应 | 无现象 | 无现象 | 无现象 |


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
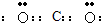
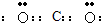


查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
考生从两道化学题中各任选一题作答
1[化学——物质结构与性质]Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布为msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是___________。
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的_________形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是_________。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小至大的顺序为_________(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其分子中σ键与π键的键数之比为_________。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于_________(填晶体类型)。
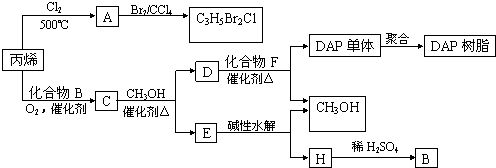
2[化学——有机化学基础]有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化:

已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为: 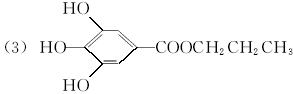 (其中:—X、—Y均为官能团)。
(其中:—X、—Y均为官能团)。
请回答下列问题:
(1)根据系统命名法,B的名称为________________。
(2)官能团—X的名称为____________,高聚物E的链节为____________。
(3)A的结构简式为________________________。
(4)反应⑤的化学方程式为____________________________________。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式。
ⅰ.含有苯环 ⅱ.能发生银镜反应 ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是____________(填序号)。
a.含有苯环 b.含有羰基 c.含有酚羟基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com