
����Ŀ��Ϊ��֤±�ص��������Ե����ǿ����ijС����ͼ��ʾװ�ý������飨�г���������ȥ���������Ѽ��飩�� 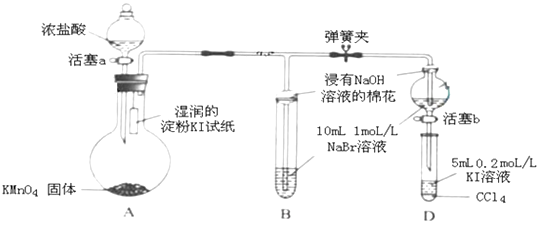
������̣�
���ɼУ�����a���μ�Ũ���ᣮ��B��C�е���Һ����Ϊ��ɫʱ���н����ɼУ���B����Һ�ɻ�ɫ��Ϊ��ɫʱ���رջ���a��������
��1��A�в�������ɫ���壬�����ʽ�� ��
��2����֤������������ǿ�ڵ��ʵ�������� ��
��3��B����Һ������Ӧ�����ӷ���ʽ�� ��
��4��Ϊ��֤���������ǿ�ڵ⣬���̢��IJ����������� ��
��5����ԭ�ӽṹ�Ƕȷ������ȡ��塢�ⵥ�ʵ�������������ԭ��ͬ����Ԫ�ش��ϵ��� �� �õ�������������
���𰸡�
��1��![]()
��2������KI��ֽ����
��3��Cl2+2Br���TBr2+2Cl��
��4������b��������C����Һ����D�У��رջ���b��ȡ��D��������CCl4����Һ��Ϊ�Ϻ�ɫ
��5��ԭ�Ӱ뾶������
���������⣺��֤±�ص��������Ե����ǿ����װ��A�����������Һ��Ũ���ᷴӦ�����Ȼ��̡��Ȼ��ء�������ˮ��װ��A��������������ƿ�϶�ʪ��ĵ⻯�ص�����ֽ����ɫ����֤������������ǿ�ڵ⣬װ��B��װ��B��ʢ���廯�ƣ���������װ��B�У���������������Ϊ�嵥�ʣ���Һ�ʳȺ�ɫ����֤�ȵ�������ǿ���壬�����ж����ܱ������������գ������������Ƶ�����ֹ������Ⱦ��������B��C�е���Һ����Ϊ��ɫʱ���н����ɼУ�Ϊ��֤���������ǿ�ڵ⣬ʵ��ʱӦ���������ĸ��ţ���B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ��˵���д����������ɣ���ʱӦ�رջ���a����������������Ӱ��ʵ����ۣ�
��1.������ɫ����Ϊ�������ɸ�����غ�Ũ���ᷢ��������ԭ��Ӧ���ɣ������д���1�����ȹ��õ��Ӷԣ���ԭ�������ﵽ8�����ȶ��ṹ������ʽΪ�� ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��
��2.�����۱���ɫ��˵���е��ʵ����ɣ�˵������������ǿ�ڵ��ʵ⣬���Դ��ǣ�����KI��ֽ������
��3.��������������ǿ���壬������ͨ��NaBr��Һ�л��е��������ɣ�������Ӧ�����ӷ���ʽΪ��Cl2+2Br���TBr2+2Cl�� �� ���Դ��ǣ�Cl2+2Br���TBr2+2Cl����
��4.��Ϊ��֤���������ǿ�ڵ⣬Ӧ��C�����ɵ�����뵽ʢ��KI��Һ��D�У��緢��������ԭ��Ӧ��������CCl4����Һ��Ϊ�Ϻ�ɫ�����Դ��ǣ�����b��������C����Һ����D�У��رջ���b��ȡ��D��������CCl4����Һ��Ϊ�Ϻ�ɫ��
��5.����ͬһ����Ԫ�أ����ϵ��£����Ӳ����������࣬ԭ�Ӱ뾶������Ԫ�صĽ���������ǿ���õ����������������Դ��ǣ�ԭ�Ӱ뾶������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ��ع��ɵıպϻ�·�У����ڵ��Ӻ������������˶������������ȷ(����)
A. ���Ӵ�ԭ��صĸ���ͨ�������ƶ�������
B. ���Ӵ�ԭ��ص�����ͨ�������ƶ���
C. �������ڵ������Һ���������ƶ�
D. �������ڵ������Һ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�������������ۣ��ֱ�������������������������Һ�У��ų���������ͬ��ͬѹ�µ����֮���ǣ� ��
A. 1:1 B. 1:6 C. 2:3 D. 3:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʣ���ʹƷ����Һ��ɫ����
A.ϡ����B.��������ҺC.ʳ��ˮD.Na2SO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ�������ǽϻ��ý���������������ȷ���ǣ���
��þ��������ˮ��������������ˮ��þ���ڼ���Һ�����������ڼ���Һ�۳�����þ������Ũ���ᣬ����������Ũ�����þ�������Ȼ����Һ�������������Ȼ�����Һ
A.�٢�
B.��
C.��
D.ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н����������������������������
A. Na2O2 B. Al2O3 C. Fe2O3 D. CaO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ֤��ϡ������ͭ��Ӧ����������ΪNO�������ͼʵ�飨ʵ������л���2Ϊ��״̬��������˵���в���ȷ���ǣ� �� 
A.�رջ���1������ϡ������Һ��a��
B.��װ������Լ��ȿ��Լӿ�ϡ������ͭ�ķ�Ӧ����
C.ͨ���رջ�������1���Կ��Ʒ�Ӧ�Ľ���
D.��Ӧ��ʼ�����·�����ɫ�������ɣ�������֤��������ΪNO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ������·���ʹ����ˮ��NO ![]() ������꣮
������꣮ 
��ش��������⣺
��1������pH���˹�����С�����������������ʽ��ͣ��Լ�X��ѡ��������ţ� A��NaOH B��Ca��OH��2 C��NH3H2O D��CO2
��2��д����Һ�����ۺ�NO ![]() ��Ӧ�����ӷ���ʽ�� ��
��Ӧ�����ӷ���ʽ�� ��
��3�����������»�ѧ��Ӧʹ����ˮ��NO3��������꣬����֮һ�ǿ�������Ҫ�ɷ֣�����������ӷ���ʽ��H2+NO ![]() +
+ ![]() +H2O��
+H2O��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com