
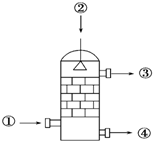
 在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )
在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )| A. | 从①处通入SO3,整个吸收操作采取逆流的形式 | |
| B. | 从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积 | |
| C. | 从③处导出的气体只含有少量SO2,可直接排入大气 | |
| D. | 从④处流出的是可用水或稀硫酸稀释的浓硫酸 |
分析 题中所给的图为工业制硫酸中的吸收塔,整个吸收操作采取逆流的形式,从吸收塔底部通入SO3,从吸收塔顶部喷下98.3%的硫酸,吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收,吸收塔不用水而用98.3%浓硫酸吸收SO3的原因是直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,但是从吸收塔处流出的是可用水或稀硫酸稀释的;二氧化硫是有毒气体,污染环境.
解答 解:A.从吸收塔底部①处通入SO3,从吸收塔顶部②处喷下98.3%的硫酸,整个吸收操作采取逆流的形式有利于吸收三氧化硫,故A正确;
B.吸收塔中填充瓷环,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收,故B正确;
C.从③处导出的气体含有SO2,还有少量氧气、氮气等,二氧化硫是有毒气体,污染环境,不能直接排入大气,应进行尾气处理,故C错误;
D.吸收塔中不能用水或稀硫酸吸收SO3,因为用水吸收会形成酸雾,从④处流出的是浓硫酸,可用水或稀硫酸稀释,故D正确;
故选C.
点评 本题重点考查工业制硫酸中第三步在吸收塔中三氧化硫的吸收以及尾气的处理,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ②④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测定等物质的量浓度的盐酸、硅酸的pH | 盐酸的pH小于硅酸的pH | 非金属性:Cl>Si |
| B | 取待测液于试管中,加一颗绿豆大的钠粒 | 有气体生成 | 检验乙酸溶液中是否混有乙醇 |
| C | 向FeI2溶液中加入少量苯,然后再通入少量Cl2 | 下层液体呈浅绿色,上层液体呈紫红色 | 还原性:I->Fe2+ |
| D | 加热分解某盐X,将产生的气体通入硝酸酸化的BaCl2溶液中 | 产生白色沉淀 | X可能是NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沙子和粘土主要成分为硅酸盐 | |
| B. | “燃薪举火”使粘土发生复杂的物理化学变化 | |
| C. | 烧制后自然冷却成红瓦,浇水冷却成青瓦 | |
| D. | 粘土是制作砖瓦和陶瓷的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳氢化合物就是烃 | |
| B. | 水、甲烷和乙烷都是10个电子的分子 | |
| C. | 乙烷的沸点比甲烷高,因而更难液化 | |
| D. | 甲烷和乙烷分子中只有一种氢,故其二氯化物也只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中溶液能电离出自由移动的离子 | |
| B. | 电极上进行的氧化还原反应的生成物为电子 | |
| C. | 有两根导线将两个活泼性不同的电极连接 | |
| D. | 电极上进行的氧化还原反应中发生了电子的转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com